
题目列表(包括答案和解析)
我国有较长的海岸线,海洋资源十分丰富。利用海水资源可以发展很多种工业,下图中包含了中学课本中介绍的几种基本工业生产,请根据各物质之间的转化关系回答下列问题:
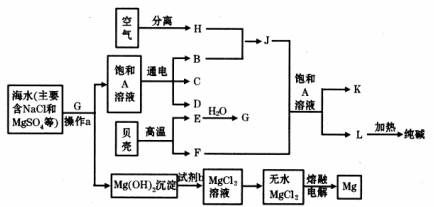
(1)从海水中提取镁的步骤中,试剂b可以选用上图中的 发生反应制取得到(以字母表示)。
(2)分离出Mg(OH)2后的溶液中除NaCl外,还含有CaCl2、Na2SO4等杂质,为了获得纯净的溶液A,在分离后的溶液中应依次加人过量的BaCl2溶液、Na2CO3溶液并过滤,再向滤液中加入适量盐酸。实验中加人过量BaCl2溶液是为了除去 离子;加入过量Na2CO3溶液发生反应的离子方程式是 。
(3)C和D、C和G反应都可以制取消毒剂。C和G反应制取的消毒剂中有效成分的化学式为 。
(4)电解A溶液时阳极反应的电极反应式为 ,当阴极产生标准状况下的气体1.12L时,整个过程中转移的电子总数为 (阿伏加德罗常数用NA表示)。
(5)将F和J通入A的饱和溶液中,反应的化学方程式为 。
(6)为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
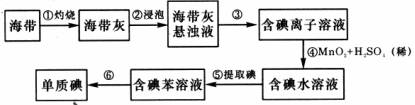
步骤⑤所选用主要仪器是 ,步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com