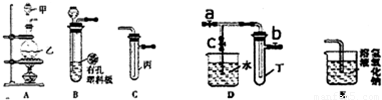
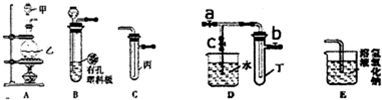
某化学兴趣小组的同学利用如图所示实验装置进行实验(图中a、b、c表示止水夹).
请按要求填空
:(1)如何检查B装置的气密性
用止水夹夹住橡皮管,向长颈漏斗中加水,若试管中液面不再改变,则装置的气密性良好.
用止水夹夹住橡皮管,向长颈漏斗中加水,若试管中液面不再改变,则装置的气密性良好.
(2)A、C、E相连后的装置可用于制取Cl
2并进行相关的性质实验.
①若在丙中加入适量水,即可制得氯水.将所得氯水分成两份,进行I、II两个实验,实验操作、现象结论如下:
实验
序号 |
实验操作 |
现象 |
结论 |
| I |
将氯水滴入品红溶液 |
溶液褪色 |
Cl2与水反应的产物有漂白性 |
| II |
氯水中加入NaHCO3粉末 |
有无色气泡产生 |
Cl2与水反应的产物具有较强的酸性 |
请你评价实验I、II的结论是否合理?若不合理,请说明理由.
实验Ⅰ结论合理,实验Ⅱ结论不合理,因为制取的氯气中含有氯化氢气体,氯化氢溶于水后能与碳酸氢钠粉末反应产生气泡;
实验Ⅰ结论合理,实验Ⅱ结论不合理,因为制取的氯气中含有氯化氢气体,氯化氢溶于水后能与碳酸氢钠粉末反应产生气泡;
②请利用上述装置设计一个简单的实验,验证C厂和B广的还原性强弱(分别指出甲、乙、丙中盛装的试剂、实验现象及结论)
在甲、乙、丙中分别装入浓盐酸、二氧化锰、溴化钠溶液,烧瓶中有黄绿色气体生成,试管中溶液由无色变为橙色,证明氯气的氧化性强于溴,则证明Br-的还原性强于Cl-.
在甲、乙、丙中分别装入浓盐酸、二氧化锰、溴化钠溶液,烧瓶中有黄绿色气体生成,试管中溶液由无色变为橙色,证明氯气的氧化性强于溴,则证明Br-的还原性强于Cl-.
(3)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得NO
2并进行有关实验.
①B中发生反应的化学方程式为
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
②欲用D装置验证NO
2与水的反应(此时c处于关闭状态),其操作步骤为
:先关闭止水夹
ab
ab
再打开止水夹
c
c
,使烧杯中的水进入试管丁的操作是
双手紧握试管丁使试管中气体逸出,二氧化氮与水接触后即可引发烧杯中的水倒流于试管丁.
双手紧握试管丁使试管中气体逸出,二氧化氮与水接触后即可引发烧杯中的水倒流于试管丁.
.
③试管丁中的NO
2与水充分反应后,若向试管内缓缓通入一定量的O
2,直至试管全部充满水,则所得溶液中溶质的物质的量浓度是
0.045mol/L
0.045mol/L
(气体按标准状况计算).