
题目列表(包括答案和解析)
几种短周期元素的原子半径及某些化合价见下表.分析判断下列说法正确的是( )
|
下列图示与对应的叙述相符的是
图4 图5 图6 图7
A.图4表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂
B.图5表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
C.图6表示在其他条件相同时,分别在T1、T2温度下由CO2和H2合成甲醇的物质的量随时间变化情况,则CO2和H2合成甲醇是吸热反应
D.图7是用0.1000mol/L的盐酸滴定20.00mLNa2CO3溶液的曲线,从a→b点反应得离子方程式为:HCO3- + H+= CO2↑ + H2O
下列图示与对应的叙述相符的是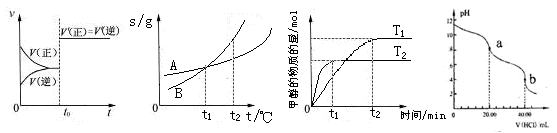 图4 图5 图6 图7
图4 图5 图6 图7
A.图4表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂
B.图5表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
C.图6表示在其他条件相同时,分别在T1、T2温度下由CO2和H2合成甲醇的物质的量随时间变化情况,则CO2和H2合成甲醇是吸热反应
D.图7是用0.1000mol/L的盐酸滴定20.00mLNa2CO3溶液的曲线,从a→b点反应得离子方程式为:HCO3- + H+ = CO2↑ + H2O
A、B、C、D四种元素的原子序数均小于18,其最高正价数依次为1、4、5、7.已知B原子核外次外层电子数为2;AC原子的核外次外层电子数为8;D元素最高价氧化物对应的水化物是已知含氧酸中最强酸.则:
(1)A、B、C、D分别是________,________,________,________.
(2)A的离子结构示意图为________,C的原子结构示意图为________.
(3)C的最高价氧化物对应的水化物与A的氢氧化物可生成________种盐,其化学式分别为________,________,________,________,________.(可不填满,也可补充)
(4)CD的气态氢化物稳定性由强到弱的顺序为________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com