
题目列表(包括答案和解析)
(14分) 某兴趣小组同学在实验室用加热l-丁醇、浓H2SO4和溴化钠混合物的方法来制备1-溴丁烷,并检验反应的部分副产物,设计了如下装置,其中夹持仪器、加热仪器及冷却水管没有画出。
请根据实验步骤,回答下列问题:
(1) 关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷。竖直冷凝管的作用是_____________________。
(2) ①理论上,上述反应的副产物可能有:丁醚、________________(填结构简式)、溴化氢、硫酸氢钠、水等。
②熄灭酒精灯,在竖直冷凝管上方塞上塞子、打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物。B、C中应盛放的试剂分别是__________;___________
③有同学通过某仪器鉴定所得产物中含有“-CH2CH2CH2CH3”, 从而确定副产物中存在丁醚。该同学的观点___________(填“正确”或“错误”)原因是____________
_______________________________________。
(3) 为了进一步分离、提纯1-溴丁烷,该兴趣小组同学查得相关有机物的有关数据如下:
请你补充下列实验步骤,直到分离出1-溴丁烷。
| 物质 | 熔点/℃ | 沸点/℃ |
| 1–丁醇 | – 89.5 | 117.3 |
| 1–溴丁烷 | – 112.4 | 101.6 |
| 丁醚 | – 95.3 | 142.4 |
| 1–丁烯 | – 185.3 | – 6.5 |
①待烧瓶冷却后,拔去竖直的冷凝管;
②插上带橡皮塞的温度计;
③______________________;
④接通冷凝管的冷凝水,使冷水从________处流入;
⑤迅速升高温度至____________℃收集所得馏分。
(4) 若实验中所取1–丁醇、NaBr分别为7.4 g、13.0 g(浓H2SO4足量),蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6 g 1–溴丁烷,则1–溴丁烷的产率是____________。
(14分) 某兴趣小组同学在实验室用加热l-丁醇、浓H2SO4和溴化钠混合物的方法来制备1-溴丁烷,并检验反应的部分副产物,设计了如下装置,其中夹持仪器、加热仪器及冷却水管没有画出。
请根据实验步骤,回答下列问题:
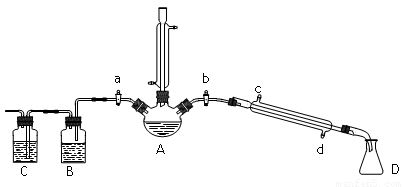
(1) 关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷。竖直冷凝管的作用是_____________________。
(2) ①理论上,上述反应的副产物可能有:丁醚、________________(填结构简式)、溴化氢、硫酸氢钠、水等。
②熄灭酒精灯,在竖直冷凝管上方塞上塞子、打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物。B、C中应盛放的试剂分别是__________;___________
③有同学通过某仪器鉴定所得产物中含有“-CH2CH2CH2CH3”, 从而确定副产物中存在丁醚。该同学的观点___________(填“正确”或“错误”)原因是____________
_______________________________________。
(3) 为了进一步分离、提纯1-溴丁烷,该兴趣小组同学查得相关有机物的有关数据如下:
请你补充下列实验步骤,直到分离出1-溴丁烷。
|
物质 |
熔点/℃ |
沸点/℃ |
|
1–丁醇 |
– 89.5 |
117.3 |
|
1–溴丁烷 |
– 112.4 |
101.6 |
|
丁醚 |
– 95.3 |
142.4 |
|
1–丁烯 |
– 185.3 |
– 6.5 |
①待烧瓶冷却后,拔去竖直的冷凝管;
②插上带橡皮塞的温度计;
③______________________;
④接通冷凝管的冷凝水,使冷水从________处流入;
⑤迅速升高温度至____________℃收集所得馏分。
(4) 若实验中所取1–丁醇、NaBr分别为7.4 g、13.0 g(浓H2SO4足量),蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6 g 1–溴丁烷,则1–溴丁烷的产率是____________。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com