
题目列表(包括答案和解析)
一定温度时,向2.0 L恒容密闭容器中充入2 mol SO2和1 mol O2,发生反应:
2SO2(g)+O2(g)  2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
| t/s | 0 | t1 | t2 | t3 | t4 |
| n(SO3)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
在一定温度和压强下,有如下可逆反应:
2SO2(g)+O2(g)(1)达到平衡时混合气体的体积为________,SO2的转化率为________.
(2)若起始时加入a mol SO2、b mol O2,且a∶b=2∶1,在相同温度和压强下,反应达到平衡时,测得混合气体的容积为120 L.则a、b的值分别为:a=________,b=________.
(3)若为体积不变的密闭容器,其容积为100 L.起始时加入x mol SO2、y mol O2和z mol SO3,反应达平衡时,温度和压强与(2)完全相同,容器内各气体的体积分数也与(2)达平衡时的情况完全相同,则x、y应该满足的关系式为________,x、z应该满足的关系式为________.
空气质量与我们的健康息息相关,目前我国通过监测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物。
(1)上述3种气体直接排入空气后会引起酸雨的气体有 (填化学式)。
(2)早期人们曾经使用铅室法生产硫酸,其主要反应为:
SO2(g)+NO2(g)![]() SO3(g)+NO(g)
SO3(g)+NO(g)
①若已知2SO2(g)+O2(g)![]() 2SO3(g) ΔH=a kJ·mol-1
2SO3(g) ΔH=a kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=b kJ·mol-1
2NO2(g) ΔH=b kJ·mol-1
则SO2(g)+NO2(g)![]() SO3(g)+NO(g) ΔH= kJ·mol-1。
SO3(g)+NO(g) ΔH= kJ·mol-1。
②一定温度下,向固定体积为2 L的密闭容器中充入SO2和NO2各1 mol,发生反应:
SO2(g)+NO2(g)![]() SO3(g)+NO(g)
SO3(g)+NO(g)
下列事实中不能说明该反应达到平衡状态的是 (选填序号)。
a.体系压强保持不变 b.混合气体的颜色保持不变
c.NO的物质的量保持不变 d.每生成1 mol SO3的同时消耗1 mol NO2
③测得②中反应5 min末到达平衡,此时容器中NO与NO2的体积比为3︰1,则这段时间内SO2的反应速率υ(SO2)= ,此反应在该温度下的平衡常数K= 。
(3)甲醇日趋成为重要的有机燃料,通常利用CO和H2合成甲醇,其反应的化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。今在一容积可变的密闭容器中,充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
CH3OH(g)。今在一容积可变的密闭容器中,充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
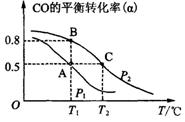
①上述合成甲醇的反应为 反应(填“放热”或“吸热”)。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为 。
③若将达到平衡状态A时生成的甲醇用于构成甲醇一氧气燃料电池,电解质溶液为KOH浓溶液,则该电池工作时正极的电极反应式为 ,理论上通过外电路的电子最多为 mol。
空气质量与我们的健康息息相关,目前我国通过监测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物。
(1)上述3种气体直接排入空气后会引起酸雨的气体有 (填化学式)。
(2)早期人们曾经使用铅室法生产硫酸,其主要反应为:
SO2(g)+NO2(g) SO3(g)+NO(g)
SO3(g)+NO(g)
①若已知2SO2(g)+O2(g) 2SO3(g) ΔH=a kJ·mol-1
2SO3(g) ΔH=a kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=b kJ·mol-1
2NO2(g) ΔH=b kJ·mol-1
则SO2(g)+NO2(g) SO3(g)+NO(g) ΔH= kJ·mol-1。
SO3(g)+NO(g) ΔH= kJ·mol-1。
②一定温度下,向固定体积为2 L的密闭容器中充入SO2和NO2各1 mol,发生反应:SO2(g)+NO2(g) SO3(g)+NO(g)。下列事实中不能说明该反应达到平衡状态的是 (选填序号)。
SO3(g)+NO(g)。下列事实中不能说明该反应达到平衡状态的是 (选填序号)。
a.体系压强保持不变 b.混合气体的颜色保持不变
c.NO的物质的量保持不变 d.每生成1 mol SO3的同时消耗1 mol NO2
③测得②中反应5 min末到达平衡,此时容器中NO与NO2的体积比为3︰1,则这段时间内SO2的反应速率υ(SO2)= ,此反应在该温度下的平衡常数K= 。
(3)甲醇日趋成为重要的有机燃料,通常利用CO和H2合成甲醇,其反应的化学方程式为CO(g)+2H2(g) CH3OH(g)。今在一容积可变的密闭容器中,充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
CH3OH(g)。今在一容积可变的密闭容器中,充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
①上述合成甲醇的反应为 反应(填“放热”或“吸热”)。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为 。
③若将达到平衡状态A时生成的甲醇用于构成甲醇一氧气燃料电池,电解质溶液为KOH浓溶液,则该电池工作时正极的电极反应式为 ,理论上通过外电路的电子最多为 mol。
钒(V)及其化合物在工业催化、新材料和新能源等领域中有广泛的应用,其中接触法制硫酸工业中就要用到V2O5作催化剂:
2SO2(g)+O2(g) 2SO3(g) ΔH<0。
某温度下,将2mol SO2和1mol O2置于10 L密闭容器中,在V2O5作催化剂下经5min反应达平衡,SO2的平衡转化率(α)为80%。
(1)5min内 v(SO3 )= mol·L-1·min-1
(2)该温度下平衡常数K=
(3)若缩小容器体积,至达到新的平衡,在图中画出反应速率变化图象。
(4)硫酸工业尾气SO2用浓氨水吸收,反应的离子方程式是 ,吸收后的产物最终可制成肥料硫铵[即(NH4)2SO4]。
(5)某含钒化合物及硫酸的电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如下图所示。
①用该电池电解(NH4)2SO4溶液生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极电极反应式可表示为 ;若电解得1mol(NH4)2S2O8,则电池左槽中H+将 (填“增大”或“减少”) mol。
②电池使用一段时间后对其进行充电,充电过程中,阳电极反应式为: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com