
题目列表(包括答案和解析)
| 步骤 | 现象 | 结论 |
分别取样于两只烧杯中,各加入少量肥皂水,搅拌 分别取样于两只烧杯中,各加入少量肥皂水,搅拌 |
产生泡沫较多 无泡沫或产生泡沫较少 产生泡沫较多 无泡沫或产生泡沫较少 |
是纯水 是硬水 是纯水 是硬水 |
| 实验序号 | 实验操作 | 实验现象 | 解释及结论 | ||||||||
| 实验I | 用砂纸擦去镁条表面氧化膜,将其放入盛有适量饱和碳酸氢钠溶液的试管中 | 迅速反应,产生大量气泡和白色不溶物 | 镁与饱和碳酸氢钠溶液反应能生成一种无色气体和一种白色不溶物 镁与饱和碳酸氢钠溶液反应能生成一种无色气体和一种白色不溶物 | ||||||||
| 实验Ⅱ | 将实验I中收集到的气体点燃,并在火焰上方罩一干、冷的小烧杯 | 气体安静燃烧、产生淡蓝色火焰, 烧杯内壁有无色小液滴生成 烧杯内壁有无色小液滴生成 . |
该气体燃烧的化学方程式为 2H2+O2
2H2+O2 .
|
| 阳离子﹨阴离子 | OH- | CO32- |
| Na+ | 溶 | 溶 |
| Mg2+ | 不 | 微 |
| 实验序号 | 实验操作 | 实验现象 | 解释及结论 |
| 实验Ⅲ | 称取22.6g实验Ⅰ中所得的白色不溶物,加入足量 稀盐酸(或稀硫酸) 稀盐酸(或稀硫酸) . |
固体溶解,产生无色气泡 | 白色不溶物中 含有 碳酸镁 碳酸镁 . |
将产生气体全部通入装置A和B中(如图所示). |
实验后装置B增重8.8g | 白色不溶物的 成分及质量分 别为 氢氧化镁5.8g、碳酸镁16.8g 氢氧化镁5.8g、碳酸镁16.8g . |
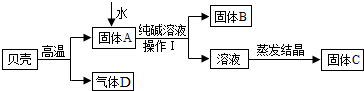
| ||
| ||
| 实验操作 | 现象 | 结论 | |
| 甲 | 取少量固体C,溶于适量水形成溶液后,滴加几滴酚酞试液 | 溶液变红 | 猜想成立 |
| 乙 | 取少量固体C,溶于适量水形成溶液后,滴加足量 稀盐酸 稀盐酸 |
无气泡产生 | 猜想不成立 |
| 丙 | 取少量固体C,溶于适量水形成溶液后,滴加几滴饱和碳酸钠溶液 | 出现白色沉淀 出现白色沉淀 |
猜想成立 |
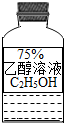 (2012?邗江区二模)油价的持续“高烧”,引发人们对未来能源供需及价格的深切关注,并且促使人们寻求石油的替代品.
(2012?邗江区二模)油价的持续“高烧”,引发人们对未来能源供需及价格的深切关注,并且促使人们寻求石油的替代品.
| ||
| ||
| 编号 | ① | ② | ③ |
| 装置 |  |
 |
 |
| 物 质 | 乙醇 | 氧气 | 二氧化碳 | 水 | 一氧化碳 |
| 反应前质量/g | 4.6 | 8 | 0 | 0 | 0 |
| 反应后质量/g | 0 | 0 | 4.4 | 5.4 | m |
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com