
题目列表(包括答案和解析)
根据上述信息同学们想一想该结晶水合物的平均分子式该怎样表示?根据我们已学过的分子的立体结构与价层电子对互斥理论及原子的杂化理论等知识来描述出H2O和CH4的中心原子的杂化方式和分子的空间立体结构。
短周期主族元素A、B、C、D、E的原子序数依次增大,其中B、D同主族,C、D、E同周期,A原子核外的L层电子数是K层的两倍,B是地壳中含量最高的元素,C是短周期元素中原子半径最大的主族元素.试回答下列问题:
(1)E原子的价电子排布式________.
(2)B、C、D三种元素形成的简单离子的半径由大到小的顺序是________.(用离子符号表示)
(3)AB2与DB2分子的空间立体结构分别是________和________,相同条件下两者在水中的溶解度较大的是________(写分子式),理由是________.
H2S分子中共价键键角接近90°,说明分子的空间立体结构为________;CO2分子中的共价键键角为180°,说明分子的空间立体结构为________;NH3分子中共价键键角为107°,说明分子的空间立体结构为________.
元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。
Ⅰ.第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。
镓(31Ga)的基态电子排布式是_________________________________________;
31Ga的第一电离能却明显低于30Zn,原因是______________________________________;
Ⅱ.第四周期过渡元素的明显特征是形成多种多样的配合物。
(1)CO和NH3可以和很多过渡金属形成配合物。CO与N2互为等电子体,CO分子中C原子上有一孤电子对,C、O原子都符合8电子稳定结构,则CO的结构式可表示为________________。NH3 分子中N原子的杂化方式为_______杂化,NH3分子的空间立体构型是____________。
(2)向盛有硫酸铜水溶液的试管中加氨水,首先形成蓝色沉淀,继续加入氨水沉淀溶解,得到深蓝色透明溶液,向该溶液中加乙醇,析出深蓝色晶体。蓝色沉淀先溶解,后析出的原因是:__________________________________________(用相关的离子方程式和简单的文字说明加以解释)
(3)如图甲所示为二维平面晶体示意图,所表示的化学式为AX3的是________。
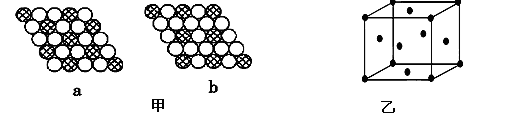
(4)图乙为一个金属铜的晶胞,此晶胞立方体的边长为acm,Cu的相对原子质量为64,金属铜的密度
为ρ g/cm3,则阿伏加德罗常数可表示为________ mol-1(用含a、ρ的代数式表示)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com