
题目列表(包括答案和解析)
 CH3OH(g)。在容积均为1L的a、b、c、d、e5个密闭容器中分别充入1mol CO和2mol H2等量混合气体,控温。实验测得相关数据如图
CH3OH(g)。在容积均为1L的a、b、c、d、e5个密闭容器中分别充入1mol CO和2mol H2等量混合气体,控温。实验测得相关数据如图 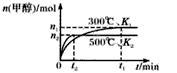
一氧化碳与氢气
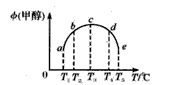
在催化剂作用下合成甲醇的反应为:CO(g)+2H2(g) ![]() CH3OH(g)。在容积均为1L的a、b、c、d、e5个密闭容器中分别充入1mol CO和2mol H2等量混合气体,控温。实验测得相关数据如下图1和图2。
CH3OH(g)。在容积均为1L的a、b、c、d、e5个密闭容器中分别充入1mol CO和2mol H2等量混合气体,控温。实验测得相关数据如下图1和图2。
下列有关说法正确的是
A.K1>K2
B.该反应的正反应是气体体积减小的吸热反应
C.反应进行到5min时,a、b两容器中平衡正向移动,d、e两容器中平衡逆向移动
D.将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有升温或减压
(1)下列实验操作或叙述正确的是 (填写编号,多选扣分)
①不宜用瓷坩埚灼烧氢氧化钠或碳酸钠固体;
②为了提高纯锌与稀硫酸反应的速率,可向稀硫酸中滴入几滴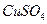 溶液;
溶液;
③用蒸馏水润湿的pH试纸测定溶液的pH一定有误差;
④向沸腾的NaOH稀溶液中滴加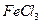 饱和溶液,可以制得
饱和溶液,可以制得 胶体;
胶体;
⑤配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸;
⑥定容时,俯视容量瓶刻度,造成所配溶液浓度偏高;
⑦称取5.85g氯化钠固体,用100 mL蒸馏水溶解,得到1.00 mol·L-1氯化钠溶液
(2)某钠盐溶液可能含有阴离子NO3-,CO32-,SO32-,SO42-,Cl-,Br-,I-。为鉴定这些离子,分别取少量溶液进行以下各步骤的实验:
步骤1测得混合液呈碱性;
步骤2滴加HCl时,溶液中出现气泡。该气体能使饱和石灰水溶液变浑浊; 步骤3加CCl4,滴加少量氯水,振荡后,CCl4层未变色;
步骤3加CCl4,滴加少量氯水,振荡后,CCl4层未变色;
步骤4加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量盐酸,沉淀不能完全溶解;
步骤5加HNO3酸化后,再加过量AgNO3,溶液中析出白色沉淀。
分析上述5个实验,回答下列问题。
①由实验步骤1判断可能存在的离子有 ;
②由实验步骤2判断可能存在的离子有几种可能性 ;分别是 ;
③由实验步骤3可得出的结论是 ;
④由实验步骤4和实验步骤5可确定肯定存在的离子有 ;
⑤由上述5个实验不能确定是否存在的离子是 。
⑴(8分)甲、乙两个实验小组分别进行“测定Na2CO3和NaCl混合物中Na2CO3含量”的实验。
甲组:沉淀分析法
把一定量的混合物溶解后加入过量CaCl2,然后将所得沉淀过滤、洗涤、烘干、称量,所得固体是 (填化学式);写出该反应的离子方程式________________________ __。
 乙组:气体分析法
乙组:气体分析法
把一定量的混合物与足量盐酸反应后,用如图装置测定产生的CO2气体的体积,为减小CO2的溶解,B中溶液应是_________________,(将选项填入空格中)
A.氢氧化钠溶液 B.饱和氯化钠溶液 C.饱和碳酸氢钠溶液
选用该溶液后实验结果还是不准确,原因是_________________________________。
⑵(5分)某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:
① Zn+盐酸;② Na+水;③ Al+NaOH溶液。为点燃上述三个反应生成的H2,他们设计了如下图(原实验)所示的装置图,请回答下列问题:
①写出Al和NaOH溶液反应的化学方程式 。
② 实验小组在点燃用此装置制得的H2时,①③实验获得成功,②却失败了。他们分析认为失败的原因是Na与H2O的反应速率太快,Na的用量又太少。于是他们准备增加钠的用量,可老师说太危险,你认为产生危险的原因是 。
③ 实验小组查阅钠、苯(一种不溶于水的液态有机物)、水的密度分别为0.97g/mL、0.88g/mL、1.00g/mL,并据此对实验进行了改进。

在改进后的实验中H2的生成速率减慢。原因是 。
(1)下列实验操作或叙述正确的是 (填写编号,多选扣分)
①不宜用瓷坩埚灼烧氢氧化钠或碳酸钠固体;
②为了提高纯锌与稀硫酸反应的速率,可向稀硫酸中滴入几滴![]() 溶液;
溶液;
③用蒸馏水润湿的pH试纸测定溶液的pH一定有误差;
④向沸腾的NaOH稀溶液中滴加![]() 饱和溶液,可以制得
饱和溶液,可以制得![]() 胶体;
胶体;
⑤配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸;
⑥定容时,俯视容量瓶刻度,造成所配溶液浓度偏高;
⑦称取5.85g 氯化钠固体,用100 mL蒸馏水溶解,得到1.00 mol·L-1 氯化钠溶液
(2)某钠盐溶液可能含有阴离子NO3-,CO32-,SO32-,SO42-,Cl-,Br-,I-。为鉴定这些离子,分别取少量溶液进行以下各步骤的实验:
步骤1测得混合液呈碱性;
步骤2滴加HCl时,溶液中出现气泡。该气体能使饱和石灰水溶液变浑浊;
![]() 步骤3加CCl4,滴加少量氯水,振荡后,CCl4层未变色;
步骤3加CCl4,滴加少量氯水,振荡后,CCl4层未变色;
步骤4加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量盐酸,沉淀不能完全溶解;
步骤5加HNO3酸化后,再加过量AgNO3,溶液中析出白色沉淀。
分析上述5个实验,回答下列问题。
①由实验步骤1判断可能存在的离子有 ;
②由实验步骤2判断可能存在的离子有几种可能性 ;分别是 ;
③由实验步骤3可得出的结论是 ;
④由实验步骤4和实验步骤5可确定肯定存在的离子有 ;
⑤由上述5个实验不能确定是否存在的离子是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com