
题目列表(包括答案和解析)

| ||
 某化学实验小组探究市售食用白醋中醋酸的准确浓度,取25.00 mL某品牌食用白醋于锥形瓶中,在实验室用浓度为cb mol/L的标准NaOH溶液对其进行滴定.
某化学实验小组探究市售食用白醋中醋酸的准确浓度,取25.00 mL某品牌食用白醋于锥形瓶中,在实验室用浓度为cb mol/L的标准NaOH溶液对其进行滴定.| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
| (23.35+25.30)c |
| 2V |
| (23.35+25.30)c |
| 2V |
某化学实验小组的同学为了探究SO2和氯水的漂白性,设计如下实验装置。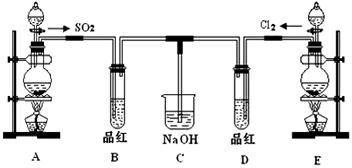
(1)C装置的作用:______________________________。
(2)实验室用装置E制备Cl2,化学反应方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。该反应中的还原剂是____________(填化学式)。
MnCl2+Cl2↑+2H2O。该反应中的还原剂是____________(填化学式)。
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B_________________________, D________________________。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为
B_________________________, D________________________。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后漂白性肯定会增强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现品红溶液未退色。请你分析产生该现象的原因_____________________________(用化学方程式表示)。
某化学实验小组探究市售食用白醋中醋酸的的准确浓度,取25.00mL某品牌食用白醋于锥形瓶中,在实验室用浓度为c mol/L的标准NaOH溶液对其进行滴定。
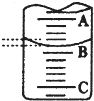
(1)如图表示50mL滴定管中液面的位置,若A与C刻度间相差l mL,A处的刻度为25,滴定管中液面读数应为 mL。

(2)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
|
实验次数 |
第一次 |
第二次 |
第三次 |
|
消耗NaOH溶液体积/mL |
26.02 |
25.35 |
25.30 |
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是 。
A.滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
C.第一次滴定用的锥形瓶未润洗
D.滴定结束时,俯视读数
(3)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(用实验原始数据列式,不必化简):c= 。
某化学实验小组的同学为了探究SO2和氯水的漂白性,设计如下实验装置。
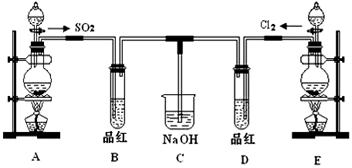
(1)C装置的作用:______________________________。
(2)实验室用装置E制备Cl2,化学反应方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。该反应中的还原剂是____________(填化学式)。
MnCl2+Cl2↑+2H2O。该反应中的还原剂是____________(填化学式)。
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B_________________________, D________________________。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为
B_________________________, D________________________。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后漂白性肯定会增强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现品红溶液未退色。请你分析产生该现象的原因_____________________________(用化学方程式表示)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com