
题目列表(包括答案和解析)
钛在地壳中的含量比铜多61倍,排第十位。钛及其化合物大量应用于航空、造船、电子、化学、医疗器械、电讯器材等各个领域。
⑴ 由钛铁矿(FeTiO3)提取金属钛(海绵钛)的主要工艺过程如下(部分产物省略):

上述熔炼过程发生的反应为吸热反应,该反应能够自发进行的原因是 ▲ ;还原过程必须在1070K的温度下进行,你认为还应该控制的反应条件是 ▲ 。
⑵ 用浓硫酸处理钛铁矿,并向所得溶液中加入铁,此时溶液中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
| 氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当溶液的pH等于 ▲ 时,Mg(OH)2开始沉淀。
 若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量
若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量
白色沉淀,写出该反应的离子方程式: ▲ 。
⑶ BaTiO3是一种可用来吸收低频波的无机功能材料。工业上,常用
BaCl2、TiCl4、H2O和H2C2O4混合反应生成白色固体A,将该白色
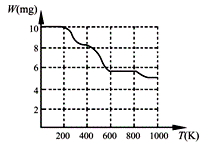
固体加热分解至900K可得BaTiO3,实验测得其热分解过程的质量
-温度关系曲线如右图所示,图中400K、600K和900K时对应的
样品的质量分别为8.38mg、5.68mg和5.19mg。白色固体A的化学式
为 ▲ (填序号)。
a.BaTi2O5 b.BaC2O4·2H2O c.BaTi(C2O4)3 d.BaTiO (C2O4)2·4H2O
钛在地壳中的含量比铜多61倍,排第十位。钛及其化合物大量应用于航空、造船、电子、化学、医疗器械、电讯器材等各个领域。
⑴ 由钛铁矿(FeTiO3)提取金属钛(海绵钛)的主要工艺过程如下(部分产物省略):

上述熔炼过程发生的反应为吸热反应,该反应能够自发进行的原因是 ▲ ;还原过程必须在1070K的温度下进行,你认为还应该控制的反应条件是 ▲ 。
⑵ 用浓硫酸处理钛铁矿,并向所得溶液中加入铁,此时溶液中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
| 氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当溶液的pH等于 ▲ 时,Mg(OH)2开始沉淀。
 若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量
若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量
白色沉淀,写出该反应的离子方程式: ▲ 。
⑶ BaTiO3是一种可用来吸收低频波的无机功能材料。工业上,常用
BaCl2、TiCl4、H2O和H2C2O4混合反应生成白色固体A,将该白色
固体加热分解至900K可得BaTiO3,实验测得其热分解过程的质量
-温度关系曲线如右图所示,图中400K、600K和900K时对应的
样品的质量分别为8.38mg、5.68mg和5.19mg。白色固体A的化学式
为 ▲ (填序号)。
a.BaTi2O5 b.BaC2O4·2H2O c.BaTi(C2O4)3 d.BaTiO (C2O4)2·4H2O
(10分)钛在地壳中的含量比铜多61倍,排第十位。钛及其化合物大量应用于航空、造船、电子、化学、医疗器械、电讯器材等各个领域。
⑴ 由钛铁矿(FeTiO3)提取金属钛(海绵钛)的主要工艺过程如下(部分产物省略):
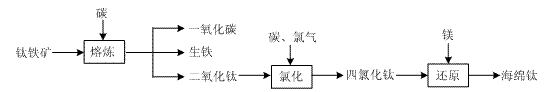
上述熔炼过程发生的反应为吸热反应,该反应能够自发进行的原因是 ;还原过程必须在1070K的温度下进行,你认为还应该控制的反应条件是 。
⑵ 用浓硫酸处理钛铁矿,并向所得溶液中加入铁,此时溶液中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当溶液的pH等于 时,Mg(OH)2开始沉淀。
 若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量
若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量
白色沉淀,写出该反应的离子方程式: 。
⑶ BaTiO3是一种可用来吸收低频波的无机功能材料。工业上,常用
BaCl2、TiCl4、H2O和H2C2O4混合反应生成白色固体A,将该白色
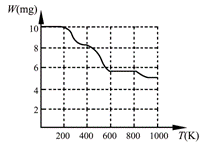
固体加热分解至900K可得BaTiO3,实验测得其热分解过程的质量
-温度关系曲线如右图所示,图中400K、600K和900K时对应的
样品的质量分别为8.38mg、5.68mg和5.19mg。白色固体A的化学式
为 (填序号)。
a.BaTi2O5 b.BaC2O4?2H2O c.BaTi(C2O4)3 d.BaTiO (C2O4)2?4H2O
钛在地壳中的含量比铜多61倍,排第十位.钛及其化合物大量应用于航空、造船、电子、化学、医疗器械、电讯器材等各个领域.
由钛铁矿(FeTiO3)提取金属钛(海绵钛)的主要工艺过程如下(部分产物省略):
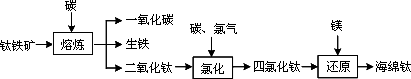
(1)氯化的过程为:将二氧化钛、炭粉混合,在高温条件下通入氯气制得TiCl4和一种可燃性气体.该反应的化学方程式为________.
(2)还原过程为:用过量的镁在高温条件下与TiCl4反应制得海绵钛.
①写出此反应的化学方程式:________.
②简述如何从上述所得产物中获得金属钛?简述步骤并写出有关反应方程式.
(3)还原过程必须
在1070 K的温度下进行,你认为还应该控制的反应条件是________.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com