
题目列表(包括答案和解析)
设反应CO2(g) + H2(g)![]() CO(g) + H2O(g) 的平衡常数为K,在不同温度下,K 的值如下:
CO(g) + H2O(g) 的平衡常数为K,在不同温度下,K 的值如下:
温度 | 830℃ | 1200℃ |
K | 1 | 2.6 |
(1)从上表可以推断:该反应的逆反应是 (填“吸”、“放”)热反应。
(2)在一体积为10 L的密闭容器中,加入一定量的CO2和H2(g),在830℃时发生上述反应,容器中各物质的浓度变化(mol/L)见下表:
时间/min | CO2 | H2 | CO | H2O |
0 | 0.100 | 0.100 | 0 | 0 |
2 | 0.065 | 0.065 | 0.035 | 0.035 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.050 | 0.050 | 0.050 | 0.050 |
6 | 0.035 | 0.0350 | 0.065 | c4 |
①前2min,用CO2表示的该化学反应的速率是
②表中3min―4min之间反应处于_________状态
③表中第5min时,该反应是否处于化学平衡状态? (填“是”或“否”),此时化学反应速率是ν正 ν逆(填“大于”、“小于”或“等于”),其原因是
④表中5min―6min之间数值发生变化,可能的原因是
a.减少了水蒸气 b.升高温度 c.使用催化剂 d.增大压强
将2mol H2和1mol CO2充入体积为10L的恒容密闭容器中,在一定条件下发生反应:
①CO2(g) + H2(g) CO(g) + H2O(g)??????? △H1=+41.2kJ·moL-1;
CO(g) + H2O(g)??????? △H1=+41.2kJ·moL-1;
②CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ? △H2=-49kJ·moL-1。
CH3OH(g) + H2O(g) ? △H2=-49kJ·moL-1。
反应100min后达到平衡,测得下表数据:
温度 | 转化率(%) | 物质的量(mol) | ||
H2 | CO2 | CH3OH | CO | |
240℃ |
| 10 | 0.05 | 0.05 |
下列说法正确的是
A.升高温度,反应①的平衡常数减小
B.升高温度,CH3OH的含量提高
C.H2转化率为10%
D.100min内,反应②的速率为v(CO2)=0.0001 mol·L-1·min-1
(8分)已知反应:CO(g) + H2O(g) H2(g) + CO2(g) ΔH=" Q" kJ·mol-1,其平衡常数随温度的变化如下表:
H2(g) + CO2(g) ΔH=" Q" kJ·mol-1,其平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 850 |
| 平衡常数 | 9.9 4 4 | 9 | 1 |
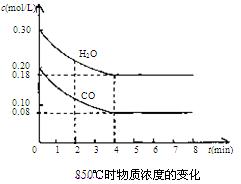
 H2(g)+CO2(g) △H=QkJ/mol,其平衡常数随温度的变化如下表
H2(g)+CO2(g) △H=QkJ/mol,其平衡常数随温度的变化如下表

高炉炼铁中发生的基本反应之一如下:
FeO(s)+ CO (g)  Fe(s)+ CO2(g) △H>0
Fe(s)+ CO2(g) △H>0
(1)此反应的平衡常数表达式为:K=
(2)温度升高,达到新的平衡后,高炉内CO2与CO的体积比 (填“增大”、“减小”或“不变”)。
(3)已知1100℃时,K= 0.263。某时刻测得高炉中c(CO2)=" 0.025" mol·L-1,c(CO)=" 0.1" mol·L-1,在这种情况下,该反应 (填“向正反应方向进行”或“向逆反应方向进行”或“处于化学平衡状态”)。
(4)由氢气和氧气反应生成1mol水蒸气放热241.8KJ,已知氢气中H-H键能为436 kJ/mol,氧气分子中 O=O键能为498 kJ/mol,则水分子中O-H键的键能为 kJ/mol 。若1 g水蒸气转化成液态水时放热2.5 kJ,则反应H2(g) + 1/2O2(g) == H2O(l)的\
△H= kJ/mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com