
题目列表(包括答案和解析)
(8分)某校化学兴趣小组对附近一化工厂排出的污水进行监测。发现污水中含某些金属离子对水质和环境造成了严重污染。他们曾对该厂排出的污水取样、过滤,对滤液进行了多次检测,其中有三次检测结果发现有如下物质:①CuCl2、FeCl3、MgSO4、H2SO4;②CuSO4、 MgCl2、Fe2 (SO4)3、HCl;③CuSO4、AgNO3、FeCl3、HCl。试回答:
(1)三次检测的结果中第________次检测的结果不正确。
(2)研究小组根据检测结果,向化工厂提出建议:用一种含钠离子的化合物来处理污水,就可以同时除去检测出的金属离子。这种化合物是_____________。
(3)在检测时,为了确定滤液中是否存在硫酸根离子和氯离子,同学们将滤液酸化后,首先向滤液中加入过量的_____________溶液,将反应后的混合物过滤,再向得到的滤液中加入_____________溶液。
(8分)(2011·广东模拟)已知一个碳原子上同时连有两个羟基时,易发生如下转化:

请根据下图回答:

(1)E中含有的官能团的名称是________,③的反应类型是________,C跟新制的氢氧化铜溶液反应的化学方程式为_______________________________________。
(2)已知B的相对分子质量为162,其燃烧产物中n(CO2) ∶n(H2O)=2 ∶1。F是电脑芯片中的高分子光阻剂的主要原料,F的特点是:①能与FeCl3溶液发生显色反应;②能发生加聚反应;③苯环上的一氯取代物只有两种。F在一定条件下发生加聚反应的化学方程式为________。
(3)化合物G是F的同分异构体,它属于芳香族化合物,能发生银镜反应。G可能有________种结构,写出其中任意一种同分异构体的结构简式_____________________。
(8分)现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验。
甲同学:向1 mol·L-1的FeCl3溶液中加少量NaOH溶液。
乙同学:直接加热饱和FeCl3溶液。
丙同学:向25 mL沸水中逐滴加入5~6滴FeCl3饱和溶液;继续煮沸至溶液呈红褐色,停止加热。
试回答下列问题:
⑴其中操作正确的同学是___ _____。
⑵证明有Fe(OH)3胶体生成利用的胶体性质是______ __。
⑶在胶体中加入电解质溶液或带有相反电荷的胶体微粒能使胶体微粒沉淀出来。丁同学利用所制得的Fe(OH)3胶体进行实验:
① 将其装入U形管内,用石墨作电极,通电一段时间后发现与电源负极相连的电极区附近的颜色逐渐变深,这表明Fe(OH)3胶体微粒带__________(填“正”或“负”)电荷。
② 若向其中加入饱和Na2SO4溶液,产生的现象是 。
③若向其中加入浓盐酸溶液,产生的现象是 。
(4)Fe(OH)3胶体制备的化学方程式为 。
(8分)(2011·广东模拟)已知一个碳原子上同时连有两个羟基时,易发生如下转化: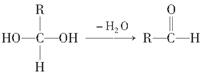
请根据下图回答:
(1)E中含有的官能团的名称是________,③的反应类型是________,C跟新制的氢氧化铜溶液反应的化学方程式为_______________________________________。
(2)已知B的相对分子质量为162,其燃烧产物中n(CO2) ∶n(H2O)=2 ∶1。F是电脑芯片中的高分子光阻剂的主要原料,F的特点是:①能与FeCl3溶液发生显色反应;②能发生加聚反应;③苯环上的一氯取代物只有两种。F在一定条件下发生加聚反应的化学方程式为________。
(3)化合物G是F的同分异构体,它属于芳香族化合物,能发生银镜反应。G可能有________种结构,写出其中任意一种同分异构体的结构简式_____________________。
(8分)经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
(1)定性分析:如图甲可通过观察___________________________________定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是____________________,
写出H2O2在二氧化锰作用下发生反应的化学方程式:
_____________________________________________________。
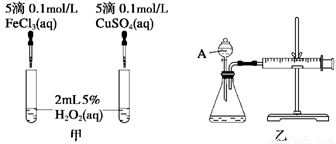
(2)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为________,实验中需要测量的数据是_________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com