
题目列表(包括答案和解析)
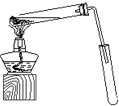 某化学实验小组用右图所示的装置制取乙酸乙酯,并检验乙 酸 乙 酯中是否含有乙酸杂质(铁架台、夹子等支撑仪器省略).已知乙酸乙酯的沸点为77.1℃,乙醇沸点为78.4℃,乙酸的沸点为118℃.请根据要求填空:
某化学实验小组用右图所示的装置制取乙酸乙酯,并检验乙 酸 乙 酯中是否含有乙酸杂质(铁架台、夹子等支撑仪器省略).已知乙酸乙酯的沸点为77.1℃,乙醇沸点为78.4℃,乙酸的沸点为118℃.请根据要求填空: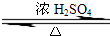 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O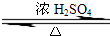 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O某化学学习小组的同学们拟用50mLNaOH溶液吸收CO2气体,制备Na2CO3溶液。为了防止通入的CO2气体过量而生成NaHCO3,他们设计了如下实验步骤: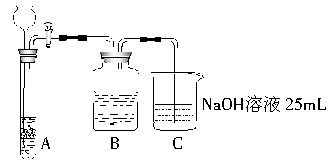
①取25mLNaOH溶液吸收过量的CO2气体,至CO2气体不再溶解(如上图所示,夹持及支撑装置未出)。
②小心煮沸溶液。
③在得到的溶液中加入另一半(25mL)NaOH溶液,使溶液充分混合。
(1)步骤②的目的是什么?操作时要注意些什么?
(2)他们能否制得较纯净的Na2CO3?___________,理由是_______________________________________。
(3)装置A中盛放的试剂是石灰石和盐酸溶液,可否使用纯碱代替石灰石?
(4)装置B中盛放的试剂是___________________,其作用是_____________________________________。
(5)有同学认为步骤②③对调,即先混合再煮沸,更合理,你认为对吗?为什么?
(6)有同学认为直接向50 mLNaOH溶液中通入足量CO2后,将所得溶液充分加热也可得到纯净的Na2CO3溶液,你认为他能否得到纯净的Na2CO3溶液?如果你认为能得到纯净的Na2CO3溶液,请与学习小组的同学们设计的方案进行比较,看哪种方案更节约药品(如果你认为不能得到纯净的Na2CO3溶液,不必评论)?
(7)如何检验他们得到的溶液是不含NaHCO3的纯净的Na2CO3溶液?
 (I)滴定分析法是化学分析法中的重要分析方法之一.
(I)滴定分析法是化学分析法中的重要分析方法之一.| 滴定次数 实验数据(mL) |
1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |

| 实验步骤 | 实验现象 | 实验结论 | |
| 实验一 | 将带火星的木条伸入装有过氧化氢溶液的试管中 | 木条不复燃 | 常温下过氧化氢溶液不分解(或分解很少) ? ? |
| 实验二 | 在装有H2O2溶液的试管中加入少量Al2O3,然后将带火星的木条伸入试管中 | 木条复燃 | Al2O3能加快H2O2溶液的分解速率 Al2O3能加快H2O2溶液的分解速率 |

已知NaHCO3的溶解度很小.在饱和的NH3和NaCl混合溶液中通入CO2,可析出NaHCO3(s):NaCl+NH3+CO2+H2O![]() NaHCO3↓+NH4Cl
NaHCO3↓+NH4Cl
据此,我国杰出的化学家侯德榜博士设计出了生产纯碱的方法:
这被人们称为侯氏制碱法,打破了帝国主义对我国经济的一种封锁,大长了中国人的民族志气.
试完成下列问题:
(1)写出由NaHCO3制取Na2CO3的化学方程式:________.
(2)如果Na2CO3(s)中混有NaHCO3(s),应如何除去?________(写出方法);如果NaHCO3(aq)中混有Na2CO3(aq),应如何除去?________(写出化学方程式).
(3)某课外活动小组,接受实验室的任务,用Na2CO3制取NaOH,提供的原料只有纯碱和石灰石.请将你的实验方案用流程图表示出来:
![]() ______________________.
______________________.
已知NaHCO3的溶解度很小.在饱和的NH3和NaCl混合溶液中通入CO2,可析出NaHCO3(s):
NaCl+NH3+CO2+H2O![]() NaHCO3↓+NH4Cl
NaHCO3↓+NH4Cl
据此,我国杰出的化学家侯德榜博士设计出了生产纯碱的方法:
这被人们称为侯氏制碱法,打破了帝国主义对我国经济的一种封锁,大长了中国人的民族志气.
试完成下列问题:
(1)写出由NaHCO3制取Na2CO3的化学方程式:________.
(2)如果Na2CO3(s)中混有NaHCO3(s),应如何除去?________(写出方法);如果NaHCO3(aq)中混有Na2CO3(aq),应如何除去?________(写出化学方程式).
(3)某课外活动小组,接受实验室的任务,因Na2CO3制取NaOH,提供的原料只有纯碱和石灰石.请将你的实验方案用流程图表示出来:
![]() ________.
________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com