
题目列表(包括答案和解析)
用离子交换法从海带中提取碘是一种较为先进的制碘工艺应用技术。
①浸泡海带:取海带500g,加13~15倍水量分两次浸泡,得浸出液6000mL左右,碘含量为0.5g/L。
②碱化浸出液除褐藻糖胶:即海带浸出液1000mL,加入浓度为40% 的NaOH溶液,控制pH值为12左右,充分搅拌后使褐藻酸钠絮状沉淀而沉降。采用倾析法分离出清液。
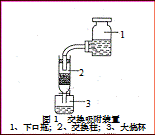 ③氧化游离:向上述清液中加入浓度为6mol× L-1的H2SO4溶液,使pH值为1.5~2。往酸化后溶液中加入NaClO溶液或H2O2溶液,充分搅拌并观察溶液颜色变化。待溶液由淡黄逐渐变成棕红色即表明I-离子已转变为多碘离子(I3-)。
③氧化游离:向上述清液中加入浓度为6mol× L-1的H2SO4溶液,使pH值为1.5~2。往酸化后溶液中加入NaClO溶液或H2O2溶液,充分搅拌并观察溶液颜色变化。待溶液由淡黄逐渐变成棕红色即表明I-离子已转变为多碘离子(I3-)。
④交换吸附:氯型强碱性阴离子交换树脂(R—Cl表示)注入交换柱中(树脂层高度为12cm),如右图连接交换装置,待溶液全部通过后,树脂颜色变为黑红色。
⑤洗脱:分两步进行
第一步:取8~10% 的NaOH溶液40mL注入交换柱中。在强碱作用下,树脂颜色逐渐变浅,待树脂基本褪色后,放出溶液,收集于一小烧杯中为碱性洗脱液。
第二步:取10% 的NaCl溶液40mL注入上述交换柱中。稍待一会儿,慢慢放出溶液收集于另一小烧瓶中,为氯化钠洗脱液。
⑥往碱性洗脱液中滴加H2SO4溶液(6mol/L),烧杯底部会析出一层泥状粗碘。
⑦往氯化钠洗脱液中滴加H2SO4溶液(6mol/L)使之酸化,再滴加10% 的NaNO2溶液(在通风橱中进行)。待溶液由无色转变为棕红色直至出现棕黑色浑浊。
⑧离心分离即得粗碘。
试回答下列问题
(1)步骤③在酸性条件下用NaClO(或H2O2)氧化碘的离子方程式: ,
及I2 +I-![]() I3-。如何用化学方法检验有多碘离子生成 。
I3-。如何用化学方法检验有多碘离子生成 。
(2)第④步发生的离子反应为: 。
(3)步骤⑤洗脱时第一步发生的离子反应为(洗脱液中含有I-和IO3-离子):
;第二步洗脱发生的离子反应为: 。
(4)步骤⑦发生反应的离子方程式为 。
海水中主要离子的含量平均值如下:
Cl-18 980 mg·L-1,Na+:10 560 mg·L-1,![]() :2 560 mg·L-1,Mg2+:1 272 mg·L-1,Ca2+:400 mg·L-1,K+:380 mg·L-1,HCO3-:142 mg·L-1
:2 560 mg·L-1,Mg2+:1 272 mg·L-1,Ca2+:400 mg·L-1,K+:380 mg·L-1,HCO3-:142 mg·L-1
海水在电渗析器中部分变成淡水的原理,示意图如图2-21所示电渗析器中由许多对阳、阴膜围成的许多“隔室”的宽度都很窄。脱盐时,各隔室相间流动着“淡水”和“浓水”;在流动着“极水”的以石墨为电极材料的两极发生电解反应。根据需要,可将几台电渗析器串联使用。图中标写的离子符号,提供思考其在电场中的迁移方向。

图2-21
回答下列问题:
(1)分别写出海水在电渗析器中脱盐时所得主要阳极产物和主要阴极产物的化学式。用以石棉布为隔膜的一般的惰性阳极电解槽来电解海水,能用以生产H2吗?为什么?__________________________________________________________________
(2)致力于发展电渗析法、反渗透法等海水淡化新技术的直接社会效益是什么?__________________________________________________________________
(3)已成功地联合应用海水淡化新技术和一般的离子交换树脂净水法,由海水制得纯水。又知海洋水能源(海洋水能发电)有其巨大的开发前景。你认为应怎样综合开发海洋能源,促成人类进入氢能时代?__________________________________________________________________
阳离子交换膜能在直流电场的作用下选择性地透过电解液中的阳离子使向阴极迁移,阴离子交换膜则能在直流电场的作用下选择性地透过电解液中的阴离子使向阳极迁移。同时在电解槽(称为“电渗析器”)中使用合适型号的这两种膜(简称“阳膜”和“阴膜”),可以在直流电场的作用下进行海水的电渗析脱盐而使海水淡化。
海水中主要离子的含量平均值如下:
Cl-18 980 mg·L-1,Na+:10 560 mg·L-1,![]() :2 560 mg·L-1,Mg2+:1 272 mg·L-1,Ca2+:400 mg·L-1,K+:380 mg·L-1,HCO3-:142 mg·L-1
:2 560 mg·L-1,Mg2+:1 272 mg·L-1,Ca2+:400 mg·L-1,K+:380 mg·L-1,HCO3-:142 mg·L-1
海水在电渗析器中部分变成淡水的原理,示意图如图2-21所示电渗析器中由许多对阳、阴膜围成的许多“隔室”的宽度都很窄。脱盐时,各隔室相间流动着“淡水”和“浓水”;在流动着“极水”的以石墨为电极材料的两极发生电解反应。根据需要,可将几台电渗析器串联使用。图中标写的离子符号,提供思考其在电场中的迁移方向。

图2-21
回答下列问题:
(1)分别写出海水在电渗析器中脱盐时所得主要阳极产物和主要阴极产物的化学式。用以石棉布为隔膜的一般的惰性阳极电解槽来电解海水,能用以生产H2吗?为什么?
(2)致力于发展电渗析法、反渗透法等海水淡化新技术的直接社会效益是什么?
(3)已成功地联合应用海水淡化新技术和一般的离子交换树脂净水法,由海水制得纯水。又知海洋水能源(海洋水能发电)有其巨大的开发前景。你认为应怎样综合开发海洋能源,促成人类进入氢能时代?
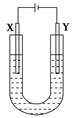
如图是用石墨和铁作电极电解饱和食盐水的装置。
请填空:
(1)X的电极名称是________极,电极反应式为_______________________________,
Y极的电极材料是____________________________________________________。
检验X极产物的方法是_____________________________________________________。
(2)某同学在实验时误将两种电极材料接反,导致X极上未收集到预期产物。一段时间后又将两极的连接方式纠正过来,发现X一端出现了白色沉淀,此沉淀是________(填化学式)。其形成原因是___________________________________________________________________,
该沉淀在空气中放置,现象是______________________________________________________。
(3)工业上电解饱和食盐水的方法之一是将两个极室用离子交换膜隔开(如图),其目的是________________________________________________________________________,阳极室(A处)加入__________,阴极室(B处)加入__________,离子交换膜只允许________通过。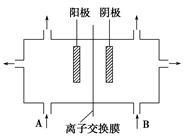

图4-39
(1)X的电极名称是_________极,发生的电极反应式为________,Y极的电极材料是_______。检验X极的产物方法是_____________________。
(2)某同学在实验时误将两种电极材料接反,导致X极上未收到预期产物。一段时间后又将两极的连接方式纠正过来,发现X一端出现了白色沉淀,此沉淀是_______(填化学式)。其形成原因是___________,该沉淀在空气中放置,现象是________________________。
(3)工业上电解饱和食盐水的方法之一,是将两个极室用离子交换膜隔开(如图4-40)其目的是_______,阳极室(A处)加入_______,阴极室(B处)加入_______,离子交换膜只许_________离子通过。
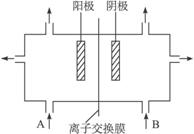
图4-40
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com