
题目列表(包括答案和解析)
20℃时,饱和KCl溶液的密度为1.174 g/cm3,物质的量浓度为4.0mol/L,则下列说法不正确的( )
A.25℃饱和KCl溶液的浓度大于4.0mol/L
B.此溶液中KCl的质量分数为 ![]()
C.25℃时,密度小于1.174g/cm3的KCl溶液是不饱和溶液
D.将此溶液蒸发部分水,再恢复到20℃时, 溶液密度大于1.174g/cm3
A.25℃时,饱和KCl溶液的浓度大于4.0mol/L
B.此溶液中KCl的质量分数为![]()
C.25℃时,密度小于1.174 g/cm3的KCl溶液是不饱和溶液
D.将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.174 g/cm3
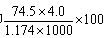 %
% 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com