
题目列表(包括答案和解析)
(14分)某化学小组利用浓盐酸和二氧化锰在加热条件下制取氯气,并利用氯气进行有关的探究实验,甲同学设计了如图所示的实验装置。
A B
(1)写出制取氯气反应的离子方程式 __________________________;装置中使用分液漏斗而不使用长颈漏斗的原因是_______________________________________
_____________________________________________________________________;
实验时为了除去氯气中的氯化氢气体,最好在A、B之间安装盛有 试剂的净化装置。
(2)若用含有0、2molHCl的MnO2反应制氯气,制得Cl2体积(标准状况下)总是小于1、12L的原因 。
(3)已知:H2CO3H++HCO3- Ka1 =4.45×10-7
HCO3-H++CO32- Ka2=5.61×10-11
HClOH++ClO- Ka=2.95×10-8
请根据以上碳酸和次氯酸的电离常数,写出下列条件下发生反应的离子方程式:①将少量氯气通入过量的碳酸钠溶液中______________________________。
⑷乙同学认为甲同学的实验有缺陷,提出在 位置后(填字母)增加一个装置,该装置中应加入 试剂,其作用 。
(14分)某化学小组利用浓盐酸和二氧化锰在加热条件下制取氯气,并利用氯气进行有关的探究实验,甲同学设计了如图所示的实验装置。
A B
(1)写出制取氯气反应的离子方程式 __________________________;装置中使用分液漏斗而不使用长颈漏斗的原因是_______________________________________
_____________________________________________________________________;
实验时为了除去氯气中的氯化氢气体,最好在A、B之间安装盛有 试剂的净化装置。
(2)若用含有0、2molHCl的MnO2反应制氯气,制得Cl2体积(标准状况下)总是小于1、12L的原因 。
(3)已知:H2CO3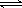 H++HCO3- Ka1 =4.45×10-7
H++HCO3- Ka1 =4.45×10-7
HCO3-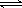 H++CO32- Ka2=5.61×10-11
H++CO32- Ka2=5.61×10-11
HClO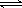 H++ClO- Ka=2.95×10-8
H++ClO- Ka=2.95×10-8
请根据以上碳酸和次氯酸的电离常数,写出下列条件下发生反应的离子方程式:①将少量氯气通入过量的碳酸钠溶液中______________________________。
⑷乙同学认为甲同学的实验有缺陷,提出在 位置后(填字母)增加一个装置,该装置中应加入 试剂,其作用 。
某化学小组利用浓盐酸和二氧化锰在加热条件下制取氯气,并利用氯气进行有关的探究实验 ,制取氯气的装置如图I和Ⅱ。
,制取氯气的装置如图I和Ⅱ。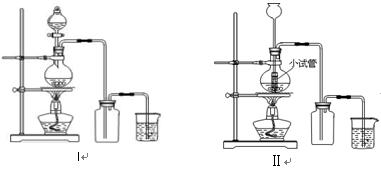
(1)制取氯气的反应的离子方程式 ;
(2)装置Ⅱ中小试管的作用为 ;
(3)装置I与装置Ⅱ比较,装置I的主要优点为: 。
(4)将生成的氯气通入水中,可制得氯水,氯水见光易分解生成 气体。
(5)氯气能使湿润的红色布条褪色。对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能,请利用中学实验室常见试剂,设计实验,得出正确结论。
| 提出问题 | 收集资料 | 提出假设 | 验证假设 | 得出结论 |
| 氯水中何种物质能使湿润的红色布条褪色? | ①Cl2有强氧化性 ②Cl2与冷水反应生成盐酸和HClO ③HClO有强氧化性 | ① 。 ②盐酸使布条褪色。 ③ 。 ④H2O使布条褪色 | 验证假设①:把红色干布条放入充Cl2的集气瓶,布条不褪色; 验证假设②: 。 验证假设④:把红色布条放在水里,布条不褪色。 | 使红色布条褪色的物质是 。 |
(14分)某化学小组利用浓盐酸和二氧化锰在加热条件下制取氯气,并利用氯气进行有关的探究实验,甲同学设计了如图所示的实验装置。
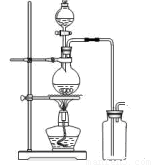
A B
(1)写出制取氯气反应的离子方程式 __________________________;装置中使用分液漏斗而不使用长颈漏斗的原因是_______________________________________
_____________________________________________________________________;
实验时为了除去氯气中的氯化氢气体,最好在A、B之间安装盛有 试剂的净化装置。
(2)若用含有0、2molHCl的MnO2反应制氯气,制得Cl2体积(标准状况下)总是小于1、12L的原因 。
(3)已知:H2CO3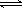 H++HCO3-
Ka1 =4.45×10-7
H++HCO3-
Ka1 =4.45×10-7
HCO3-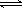 H++CO32-
Ka2=5.61×10-11
H++CO32-
Ka2=5.61×10-11
HClO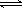 H++ClO-
Ka=2.95×10-8
H++ClO-
Ka=2.95×10-8
请根据以上碳酸和次氯酸的电离常数,写出下列条件下发生反应的离子方程式:①将少量氯气通入过量的碳酸钠溶液中______________________________。
⑷乙同学认为甲同学的实验有缺陷,提出在 位置后(填字母)增加一个装置,该装置中应加入 试剂,其作用 。
某化学小组利用浓盐酸和二氧化锰在加热条件下制取氯气,并利用氯气进行有关的探究实验,制取氯气的装置如图I和Ⅱ。
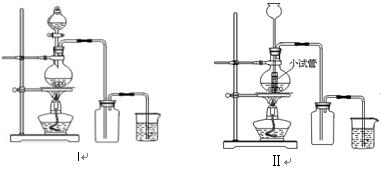
(1)制取氯气的反应的离子方程式 ;
(2)装置Ⅱ中小试管的作用为 ;
(3)装置I与装置Ⅱ比较,装置I的主要优点为: 。
(4)将生成的氯气通入水中,可制得氯水,氯水见光易分解生成 气体。
(5)氯气能使湿润的红色布条褪色。对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能,请利用中学实验室常见试剂,设计实验,得出正确结论。
| 提出问题 | 收集资料 | 提出假设 | 验证假设 | 得出结论 |
| 氯水中何种物质能使湿润的红色布条褪色? | ①Cl2有强氧化性 ②Cl2与冷水反应生成盐酸和HClO ③HClO有强氧化性 | ① 。 ②盐酸使布条褪色。 ③ 。 ④H2O使布条褪色 | 验证假设①:把红色干布条放入充Cl2的集气瓶,布条不褪色; 验证假设②: 。 验证假设④:把红色布条放在水里,布条不褪色。 | 使红色布条褪色的物质是 。 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com