
题目列表(包括答案和解析)
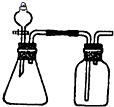 Ⅰ、利用下列各组物质制备和收集相应的气体,可采用如右下图所示装置(图中尾气处理装置略)的是
Ⅰ、利用下列各组物质制备和收集相应的气体,可采用如右下图所示装置(图中尾气处理装置略)的是| 放电 | 充电 |
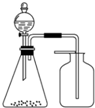 利用下列各组物质制备和收集少量相应气体,能采用如图实验装置的是( )
利用下列各组物质制备和收集少量相应气体,能采用如图实验装置的是( )| A、浓氨水与固体CaO | B、FeS与稀硫酸 | C、稀硝酸与铜片 | D、电石与水 |
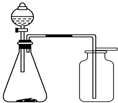
| A、浓氨水和固体NaOH制NH3 | B、过氧化氢溶液和二氧化锰制O2 | C、稀硝酸和铜片制NO | D、电石和饱和食盐水制乙炔 |
某学习兴趣小组探究废干电池(锌筒内填有炭粉、MnO2、NH4Cl等的糊状物)的回收利用,并用回收的物质进行如下实验。
I.(1)从废干电池中提取NH4Cl。
① 利用该糊状物提取NH4Cl前两步的操作为:a.溶解 b. 。
② 甲同学设想:将分离出的NH4Cl溶液蒸发、结晶、灼烧,就可以制得纯净的NH4Cl。请对甲同学的方案作出评价并说明理由:______________________________________
。
(2)制取氨气。
① 乙同学要制备并收集到纯净的氨气,下列各反应及操作中合理的是
a.将氯化铵固体加热分解 b.将浓氨水滴入氢氧化钠固体中
c.将氢氧化钠固体加入浓氨水中 d.将氯化铵浓溶液滴入氢氧化钠固体中
② 乙同学认为将集气瓶正放在桌上(如图所示),就可以收集到纯净的氨气。
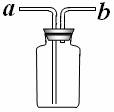
你若认为可行,请说明其操作:_____________________________。
你若认为不可行,请说明其理由:___________________________。
Ⅱ.丙同学利用上面得到的氨气制取氨水并进行了如下探究实验:
(3)为探究NH3?H2O是否是弱电解质。
丙同学设计方案如下:① 将1.12L(标况)NH3完全溶于水,配得溶液500mL;
② ;③分析数据,即
可得出结论。
请把最简单的实验步骤②,填写在上面的空格中。
(4)探究氨水与盐酸的反应过程。
丙同学进行了如下实验:向25mL上述氨水中逐滴滴加同浓度的盐酸,测定反应过程中溶液pH并绘制其pH变化曲线(如图)。请回答:
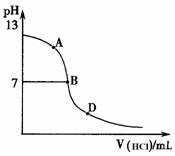
①酸碱恰好完全中和时的pH点应是_________
(填A或B或D),此时溶液中c(NH3?H2O)+c(NH4+)=______mol?L-1,溶液中
各离子的浓度由大到小的顺序为 。
III.请参与探究
(5)请完成以下探究实验报告。
【探究课题】比较在25℃、0.1mol?L-1的NH3?H2O溶液和0.1mol?L-1的NH4Cl溶液中,NH3?H2O的电离程度与NH4+水解程度的相对大小。
【探究方案】
(08淄博市模拟)(18分)某学习兴趣小组探究废干电池(锌筒内填有炭粉、MnO2、NH4Cl等的糊状物)的回收利用,并用回收的物质进行如下实验。
I.(1)从废干电池中提取NH4Cl。
① 利用该糊状物提取NH4Cl前两步的操作为:a.溶解 b. 。
② 甲同学设想:将分离出的NH4Cl溶液蒸发、结晶、灼烧,就可以制得纯净的NH4Cl。请对甲同学的方案作出评价并说明理由:______________________________________
。
(2)制取氨气。
① 乙同学要制备并收集到纯净的氨气,下列各反应及操作中合理的是
a.将氯化铵固体加热分解 b.将浓氨水滴入氢氧化钠固体中
c.将氢氧化钠固体加入浓氨水中 d.将氯化铵浓溶液滴入氢氧化钠固体中

② 乙同学认为将集气瓶正放在桌上(如图所示),就可以收集到纯净的氨气。
你若认为可行,请说明其操作:_____________________________。
你若认为不可行,请说明其理由:___________________________。
Ⅱ.丙同学利用上面得到的氨气制取氨水并进行了如下探究实验:
(3)为探究NH3?H2O是否是弱电解质。
丙该同学设计方案如下:① 将1.12L(标况)NH3完全溶于水,配得溶液500mL;
② ;③分析数据,即
可得出结论。
请把最简单的实验步骤②,填写在上面的空格中。
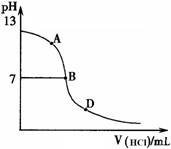 (4)探究氨水与盐酸的反应过程。
(4)探究氨水与盐酸的反应过程。
丙同学进行了如下实验:向25mL上述氨水中逐
滴滴加同浓度的盐酸,测定反应过程中溶液pH并绘
制其pH变化曲线(如图)。请回答:
①酸碱恰好完全中和时的pH点应是_________
(填A或B或D),此时溶液中c(NH3?H2O)+c(NH4+)=______mol?L-1,溶液中
各离子的浓度由大到小的顺序为 。
III.请参与探究
(5)请完成以下探究实验报告。
【探究课题】比较在25℃、0.1mol?L-1的NH3?H2O溶液和0.1mol?L-1的NH4Cl溶液中,NH3?H2O的电离程度与NH4+水解程度的相对大小。
【探究方案】湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com