
题目列表(包括答案和解析)
(本题共16分)将1.68克铁粉投入100mL稀硝酸中,两物质恰好完全反应,硝酸的还 原产物全部是NO。向反应后的溶液中加入一定量的NaOH溶液,恰好使铁元素完全转化为沉淀,过滤,将滤渣洗涤、干燥、灼烧、称重,得固体a克,把滤液蒸干、灼烧、称重,得固体b克。
原产物全部是NO。向反应后的溶液中加入一定量的NaOH溶液,恰好使铁元素完全转化为沉淀,过滤,将滤渣洗涤、干燥、灼烧、称重,得固体a克,把滤液蒸干、灼烧、称重,得固体b克。
根据题意完成第57~60题:
57.此硝酸的物质的量浓度范围是 ;
58.a克固体的成份是 ,质量为 克;
b克固体的成份是 ,质量范围为 克。
59.假如反应中放出NO的体积(标况下)为582.4 mL,若向铁与硝酸反应后的溶液中继续加入铁屑,该溶液还能溶解的铁的质量为 。
60.已知:25℃时NaOH的溶解度为118克/100克水。25℃时,把15克NaOH固体溶解在一定量水中,配成20克溶液,其密度为1.44g/mL。用该溶液去沉淀铁与硝酸反应后的溶液中的全部铁元素,至少需要取该NaOH溶液 mL。
(本题共16分)将1.68克铁粉投入100mL稀硝酸中,两物质恰好完全反应,硝酸的还原产物全部是NO。向反应后的溶液中加入一定量的NaOH溶液,恰好使铁元素完全转化为沉淀,过滤,将滤渣洗涤、干燥、灼烧、称重,得固体a克,把滤液蒸干、灼烧、称重,得固体b克。
根据题意完成第57~60题:
57.此硝酸的物质的量浓度范围是 ;
58.a克固体的成份是 ,质量为 克;
b克固体的成份是 ,质量范围为 克。
59.假如反应中放出NO的体积(标况下)为582.4 mL,若向铁与硝酸反应后的溶液中继续加入铁屑,该溶液还能溶解的铁的质量为 。
60.已知:25℃时NaOH的溶解度为118克/100克水。25℃时,把15克NaOH固体溶解在一定量水中,配成20克溶液,其密度为1.44g/mL。用该溶液去沉淀铁与硝酸反应后的溶液中的全部铁元素,至少需要取该NaOH溶液 mL。
(本题共16分)将1.68克铁粉投入100mL稀硝酸中,两物质恰好完全反应,硝酸的还原产物全部是NO。向反应后的溶液中加入一定量的NaOH溶液,恰好使铁元素完全转化为沉淀,过滤,将滤渣洗涤、干燥、灼烧、称重,得固体a克,把滤液蒸干、灼烧、称重,得固体b克。
根据题意完成第57~60题:
57.此硝酸的物质的量浓度范围是 ;
58.a克固体的成份是 ,质量为 克;
b克固体的成份是 ,质量范围为 克。
59.假如反应中放出NO的体积(标况下)为582.4 mL,若向铁与硝酸反应后的溶液中继续加入铁屑,该溶液还能溶解的铁的质量为 。
60.已知:25℃时NaOH的溶解度为118克/100克水。25℃时,把15克NaOH固体溶解在一定量水中,配成20克溶液,其密度为1.44g/mL。用该溶液去沉淀铁与硝酸反应后的溶液中的全部铁元素,至少需要取该NaOH溶液 mL。
(16分) 氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300-1700oC的氮气流中反应制得3SiO2(s)+6C(s)+2N2(g)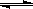 Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(1)上述反应氧化剂是 ,已知该反应每转移1mole—,放出132.6kJ的热量,该方程式的∆H = 。
(2)能判断该反应(在体积不变的密闭容器中进行)已经达到平衡状态的是( )
A.焦炭的质量不再变化 B.N2 和CO速率之比为1:3
C.生成6molCO同时消耗1mol Si3N4 D.混合气体的密度不再变化
(3)下列措施中可以促进平衡右移的是( )
A.升高温度 B.降低压强 C.加入更多的SiO2 D.充入N2
(4)该反应的温度控制在1300-1700oC的原因是 。
(5)某温度下,测得该反应中N2和CO各个时刻的浓度如下,求0—20 min内N2的平均反应速率 ,该温度下,反应的平衡常数K= 。
|
时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
30 |
35 |
40 |
45 |
|
N2浓度/mol·L-1 |
4.00 |
3.70 |
3.50 |
3.36 |
3.26 |
3.18 |
3.10 |
3.00 |
3.00 |
3.00 |
|
CO浓度/mol·L-1 |
0.00 |
0.90 |
1.50 |
1.92 |
2.22 |
2.46 |
2.70 |
|
|
|
 如图装置可用于多项定量实验.图中夹持固定装置已略去,甲有刻度,供量气用.
如图装置可用于多项定量实验.图中夹持固定装置已略去,甲有刻度,供量气用.| 酸溶液 | 酸溶液 | 气体体积/mL | 反应时间 | |
| (实验A) | (实验B) | (25℃、101 kPa) | 实验A | 实验B |
| CH3COOH0.1 mol/L40.00mL | HCl溶液 0.1 mol/L 40.00mL |
5 | t(a1)=155 s | t(b1)=7 s |
| 10 | t(a2)=310 s | t(b2)=16 s | ||
| 15 | t(a3)=465 s | t(b3)=30 s | ||
| 20 | t(a4)=665 s | t(b4)=54 s | ||
| … | … | … | ||
| 65V×10-3 |
| 2ρSVm |
| 65V×10-3 |
| 2ρSVm |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com