
题目列表(包括答案和解析)
| ||
| △ |
| ||
| △ |
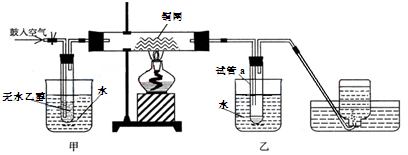
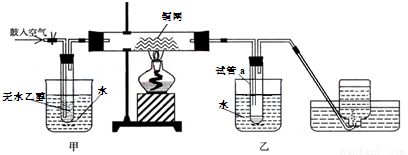
西师附中化学教师们在平时的教学过程中深入思考、积极探索将书本上的乙醇催化氧化的实验装置作如下改进,并用该装置进行演示实验:

(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学反应方程式:
____________________________________________________________________
____________________________________________________________________
在鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇氧化反应是________反应。
(2)甲和乙两个水浴的作用不相同。
甲的作用是:_______________________ 乙的作用是:______________________
(3)反应一段时间后,干燥试管a中能收集到不同的液态物质。
它们是:___________________________________________________
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有________,要除去该物质,可以先在混合液中加入____________(填写字母)
A.氯化钠溶液 B.苯 C.碳酸氢钠溶液 D.四氯化碳
然后,再通过____________(填实验操作名称)即可除去。
 CH3CHO+Cu+H2O
CH3CHO+Cu+H2O电池在人们的日常生活、工农业生产、教学、科研等各个方面具有广泛的应 用。电池按不同的划分标准可以划分为不同的种类,用氧化还原反应设计的电池统称 为化学电源。
(1) 化学电源能够把________能转化为________能。组成原电池的条件 之一是________插入电解质溶液中。下列属于化学电源的有_________。①蓄电池 ② 锌锰电池③充电电池④一次性电池
(2)化学电源的组成可以表示为:(一)负极材料‖A‖正极材料(+)。A表示________,
离子在A中的电阻比电子在金属中的电阻________。对于不漏电的电池电子A中 ________(填通过、不通过)。
(3)1991年Sony公司首次推出商品化的锂离子电池,此后锂离子电池,此后锂子电 池的厂家如雨后春笋般在全世界出现,锂离子电池的品种和数量也在逐年增加。锂离 子电池的电压高,单个电池的电压是3.6V。锂离子电池的正极材料是锂的过渡金属氧 化物(例如LiCoO2)混以一定量的导电添加物(例如C)构成的混合导体,负级材料 是可插入锂的碳材料。
①锂在元素周期表中位于第________周期,第________族。②锂离子电池所用的下负 极材料都是不污染环境的无毒无害物质,作为密封电池无毒无害,可以放心使用,属 于绿色能源。而铝镍在生产过程中污染环境。铝镍电池的有毒物质是________,它作 为电池的________级。
硫及其化合物有广泛的应用,对SO2性质的研究是高中化学教学的一项重要内容。
I.对比研究是一种重要的研究方法。若将硫的单质及部分化合物按如下表所示分成3 组,则第2组中物质M的化学式是 。
|
第1组 |
第2组 |
第3组 |
|
S (单质) |
SO2、H2SO3、M、NaHSO3 |
SO3、H2SO4、Na2SO4、 NaHSO4 |
Ⅱ.某校化学学习小组用下图所示的实验装置研究SO2气体还原Fe3+、Br2的反应。

(1)下列实验方案可以用于在实验室制取所需SO2的是 。
A.Na2SO3溶液与HNO3 B.Na2SO3固体浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热的浓硫酸
(2)装置C的作用是除去多余的SO2,防止污染空气。已知在用氢氧化钠溶液吸收SO2的 过程中,往往得到Na2SO3和NaHSO3的混合溶液,常温下,溶液pH随n(SO32—):n(HSO3—)变化关系如下表
|
n(SO32—):n(HSO3—) |
91:9 |
1:1 |
9:91 |
|
pH |
8.2 |
7.2 |
6.2 |
当吸收液中n(SO32—):n(HSO3—) =10:1时,溶液中离子浓度关系正确的是 。
A.c(Na+)+ c(H+)= 2c(SO32—)+ c(HSO3—)+ c(OH—)
B.c(Na+)>c(HSO3—)>c(SO32—)>c(OH—)>c(H+)
C.c(Na+)>c(SO32—)>c(HSO3—)>c(OH—)>c(H+)
(3)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中反应后的溶液分成三份,并设计了如下探究实验,请你评价并参与他们的探究过程(限选试剂:KMnO4溶液、KSCN溶液、BaCl2溶液、稀硫酸、稀盐酸、稀硝 酸、Ba(NO3)2溶液、新制的氯水)
|
序号 |
实验方案 |
实验现象 |
结论 |
|
方案① |
往第一份试液中加入KMnO4溶液溶液 |
紫红色褪去 |
SO2与Fe3+反应生成了Fe2+ |
|
方案② |
往第二份试液中加入 |
|
SO2与Fe3+反应生成了Fe2+ |
|
方案③ |
往第二份试液中加入 |
|
SO2与Fe3+反应生成了SO42— |
上述方案①得出的结论是否合理 ,原因 。
如果他们设计的方案②与方案③均合理并且得到相应结论,请你将上面表格补充完整。
(4)装置B中能表明Br—的还原性弱于SO2的现象是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com