
题目列表(包括答案和解析)
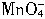 +2H2O=2Mn2++5
+2H2O=2Mn2++5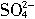 +4H+
+4H+现有药品:0.1mol/L的酸性KMnO4溶液、颗粒吸附剂、品红试纸、pH试纸。
(1)配置250mL0.1mol/L的酸性KMnO4溶液需要用到的仪器有__________________、__________________、玻璃棒、胶头滴管、烧杯等,玻璃棒的作用是________________和________________。
(2)在测定SO2含量和可吸入颗粒的含量时,首先应测定________________,因为__________________________。
(3)写出SO2与酸性KMnO4溶液反应的离子方程式:_________________________________。
(4)若气体的流速为acm3/min,当tmin时,200mL0.1mol/L的酸性KMnO4溶液恰好完全褪色,则空气中的SO2的含量为___________g/cm3。
中央电视台每晚《晚间新闻》后,都要预报42个重点城市的空气质量,它一般将这些城市空气中的 和可吸入颗粒的含量(可用
和可吸入颗粒的含量(可用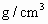 )分为8个等级.目前,测定空气中
)分为8个等级.目前,测定空气中 含量主要用氧化还原反应原理测定.假如给你一个气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用),请你设计一个实验装置,测定你所在地区的空气中
含量主要用氧化还原反应原理测定.假如给你一个气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用),请你设计一个实验装置,测定你所在地区的空气中 和可吸入颗粒的含量.
和可吸入颗粒的含量.
已知: 气体与酸性
气体与酸性 溶液反应时,
溶液反应时, 被还原为
被还原为 ,
, 被氧化成
被氧化成 .
.
现有药品:0.1mol/L的酸性 溶液、颗粒吸附剂、品红试液、pH试纸.
溶液、颗粒吸附剂、品红试液、pH试纸.
现有仪器:密闭容器用 或
或 表示,敞口仪器用
表示,敞口仪器用 ;导管用
;导管用 ;气体流速管用
;气体流速管用 .
.
(1)配制200mL0.1mol/L酸性 溶液,需用仪器有玻璃棒、____________、________________、___________、_______________.玻璃棒的作用是____________________、__________________________.
溶液,需用仪器有玻璃棒、____________、________________、___________、_______________.玻璃棒的作用是____________________、__________________________.
(2)画出测定空气中 和可吸入颗粒含量的实验装置图(并指出仪器中的药品).
和可吸入颗粒含量的实验装置图(并指出仪器中的药品).
(3)若气体流速管中气体流速为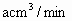 ,当tmin后200mL0.1mol/L
,当tmin后200mL0.1mol/L 溶液恰好褪色.求空气中
溶液恰好褪色.求空气中 的含量(
的含量(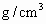 ).
).
(4)若要测定空气中可吸入颗粒的含量,需要测出的数据有___________.
空气中 的含量还可用检测管测定,其原因是:指示剂
的含量还可用检测管测定,其原因是:指示剂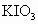 发生作用,可能发生的反应(未配平)有:
发生作用,可能发生的反应(未配平)有:
①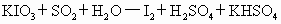
②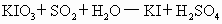
(5)检气管是按照上述两个方程式中的____________方程式设计的.如果是按另一方程式设计的实验程序,能检测出空气中的二氧化硫的含量吗?__________________(填“能”“不能”或“无法确定”),理由是_____________________________________________________________.
(6)为了能够准确地测定出空气中的二氧化硫的含量,拉动采样器的手柄则应该注意的是____________________,理由是____________________.
| 实验方法 | 实验现象 | 结 论 |
| 分别向A、B溶液中加 KSCN溶液 |
固体物质中有FeCl3 | |
| 分别向KMnO4溶液中 加适量A、B溶液 |
KMnO4溶液颜色无明显变化 | 固体物质中不含 |
| 氢氧化物 开始沉淀时的pH |
氢氧化物 沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
| 提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu | ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com