
题目列表(包括答案和解析)
离子反应是中学化学中重要的反应类型。回答下列问题:
(1)人们常用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可表示为下左图。下右图为离子反应、氧化还原反应和置换反应三者之间的关系,则表示离子反应、氧化还原反应、置换反应的字母分别是

(2)将NaBr溶液加入AgC1沉淀中,产生AgBr黄色沉淀。从离子反应发生的条件分析,AgCl与AgBr相比较,溶解度较大的是 。
(3)离子方程式是重要的化学用语。下列是有关离子方程式的一些错误观点,请在下列表格中用相应的“离子方程式”否定这些观点。www.tesoon.com反应物从下列物质中选取:Ca(OH)2、Fe、H2O、CO2、H2SO4、HCl、NaOH、Ba(OH)2、CuCl2、
| 错误观点 | “否定的”离子方程式 | |
| ① | 所有碱溶液与CO2反应均可以表示为: 2OHˉ+CO2 =H2O+ CO32— | |
| ② | 所有酸碱中和反应均可表示为: H++OHˉ=H2O |
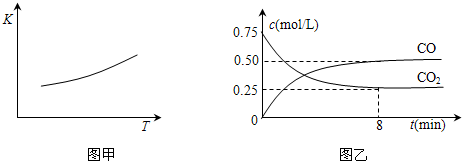
| 电解 |
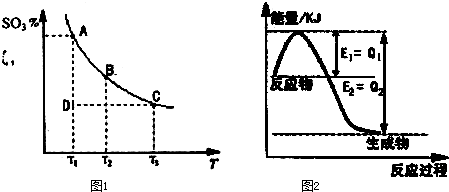
(12分)离子反应是中学化学中重要的反应类型。回答下列问题:
(1)人们常用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可表示为下左图。下右图为离子反应、氧化还原反应和置换反应三者之间的关系,则表示离子反应、氧化还原反应、置换反应的字母分别是
(2)将NaBr溶液加入AgC1沉淀中,产生AgBr黄色沉淀。从离子反应发生的条件分析,AgCl与AgBr相比较,溶解度较大的是 。
(3)离子方程式是重要的化学用语。下列是有关离子方程式的一些错误观点,请在下列表格中用相应的“离子方程式”否定这些观点。反应物从下列物质中选取:Ca(OH)2、Fe、H2O、CO2、H2SO4、HCl、NaOH、Ba(OH)2、CuCl2、
|
| 错误观点 | “否定的”离子方程式 |
| ① | 所有碱溶液与CO2反应均可以表示为: 2OHˉ+CO2 =H2O+ CO32— |
|
| ② | 所有酸碱中和反应均可表示为: H++OHˉ=H2O |
|
(12分)离子反应是中学化学中重要的反应类型。回答下列问题:
(1)人们常用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可表示为下左图。下右图为离子反应、氧化还原反应和置换反应三者之间的关系,则表示离子反应、氧化还原反应、置换反应的字母分别是 
(2)将NaBr溶液加入AgC1沉淀中,产生AgBr黄色沉淀。从离子反应发生的条件分析,AgCl与AgBr相比较,溶解度较大的是 。
(3)离子方程式是重要的化学用语。下列是有关离子方程式的一些错误观点,请在下列表格中用相应的“离子方程式”否定这些观点。www.tesoon.com反应物从下列物质中选取:Ca(OH)2、Fe、H2O、CO2、H2SO4、HCl、NaOH、Ba(OH)2、CuCl2、
| | 错误观点 | “否定的”离子方程式 |
| ① | 所有碱溶液与CO2反应均可以表示为: 2OHˉ+CO2 =H2O+ CO32— | |
| ② | 所有酸碱中和反应均可表示为: H++OHˉ=H2O | |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com