
题目列表(包括答案和解析)
 瑞典皇家科学院宣布,将2010年诺贝尔物理学奖授予 英国曼彻斯特大学科学家安德烈?海姆和康斯坦丁?诺沃肖洛夫,以表彰他们在石墨烯材料方面的卓越研究.石墨烯是由碳原子构成的单层片状结构的新材料.具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性.制备石墨烯方法有石墨剥离法、化学气相沉积法等.石墨烯的球棍模型及分子结构如图1所示.
瑞典皇家科学院宣布,将2010年诺贝尔物理学奖授予 英国曼彻斯特大学科学家安德烈?海姆和康斯坦丁?诺沃肖洛夫,以表彰他们在石墨烯材料方面的卓越研究.石墨烯是由碳原子构成的单层片状结构的新材料.具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性.制备石墨烯方法有石墨剥离法、化学气相沉积法等.石墨烯的球棍模型及分子结构如图1所示.已知A、B、C、D、E、F六种元素的原子序数依次递增, A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;A、E的原子序数相差10,F+的M层电子全充满。
请回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)
(1)C的基态原子的外围电子排布式为 ,周期表中F
属于 区。
(2)C、D、E三元素的电负性由大到小的顺序为: ,简单离子半径由大到小的顺序为: 。
(3)BD分子中,B原子与D原子都达到8电子稳定结构,则BD的电子式是 ;
(4)BD2与EDA反应时,通过控制反应物的物质的量之比,可以得到不同的产物,相同条件下,在水中溶解度较小的产物是 (写化学式),其原因是该化合物阴离子间可形成二聚离子或多聚链状离子。该化合物阴离子能够相互缔合的原因是: 。
 (5)B2D42-和 (分子)是等电子体,B2D42-离子具有较强的还原性,它能使酸性KMnO4溶液褪色(还原产物为Mn2+),写出变化的离子方程式: 。
(5)B2D42-和 (分子)是等电子体,B2D42-离子具有较强的还原性,它能使酸性KMnO4溶液褪色(还原产物为Mn2+),写出变化的离子方程式: 。
(6)右图分别是E和F的晶胞。晶体中E和F的配位数之比为 。
(7)相同条件下,V1mLBD2与V2mLCD的混合气体通过足量E2D2固体后,气体体积变为(V1+V2)/2mL(不考虑CD与E2D2的反应),则V1与V2的关系满足: 。
a、b、c、d、e、f、g是原子序数依次增大的前20号元素,其中只有g为金属元素,a是周期表中原子半径最小的元素,b的最外层电子数为电子层数的两倍,b、e,d、f同主族,且d是地壳中含量最多的元素.试回答下列问题:
(1)a元素中没有中子的同位素的原子组成符号为________,c与a按原子数目比为1∶3构成分子构型为________;a与g的单质可按2∶1化合,试用电子式表示其形成过程________.
(2)a与d形成的化合物中有一种称为“绿色氧化剂”.写出酸性条件下该化合物与FeSO4溶液反应的离子方程式:________.
(3)bf2的结构式为________,它是一种常见的溶剂,通常条件下1克该物质完全燃烧会释放出7.8 kJ的热,试写出该物质燃烧热的热化学方程式:
________.
(4)标准状况下c的氢化物溶解度为700,用c的氢化物做喷泉实验后所形成的溶液密度为ρg/cm3,该溶液的物质的量浓度C=________(此空用数据列出表达式即可).
(5)已知单质
A为常见黑色固体粉末,B是元素f的最高价含氧酸,其存在如图所示的转换关系: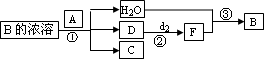
(Ⅰ)若向C中滴加KSCN溶液立即呈血红色.则:
常温下A在B的浓溶液中难以溶解,因此反应①的条件是________;在工业上反应③是在________(填设备)中进行的;在实验室用________(填药品名)检验D的存在;含D的尾气直接排放到大气中造成环境污染的后果是________.(Ⅱ)若A是元素b的单质写出反应①的化学方程式:________.
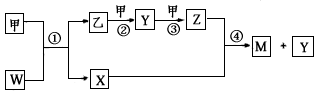
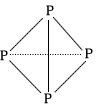 ,请画出C4A44+(每个原子最外层均达到 稳定结构)的结构式:___(A、C用元素符号表示)。
,请画出C4A44+(每个原子最外层均达到 稳定结构)的结构式:___(A、C用元素符号表示)。 常见元素X、Y、Z、W的原子序数依次增大,其相关信息如下表:
| 元素 | 相关信息 |
| X | X的基态原子核外只有三个能级,且各能级电子数相等 |
| Y | Y的基态原子最外层电子数是其内层电子总数的2.5倍 |
| Z | Z的基态价电子结构为nsn-1 |
| W | W单质常在火山口附近被发现,其氧化物是造成酸雨的主要原因之一 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com