
题目列表(包括答案和解析)
| 稀硫酸 |
为探究铜与浓硫酸的反应,某兴趣小组进行了如下实验。
【实验1】铜与浓硫酸反应,实验装置如图所示。
(1)、装置A中发生反应的化学方程式为:
(2)、熄灭酒精灯后,因为有导管存在,B中的液体不会倒吸,其原因是: 。
拆除装置前,不打开胶塞,为了使装置中的残留气体完全被吸收,应当采取的操作是: 。
【实验2】实验中发现试管内除了产生白色固体外,在铜丝表面还有黑色固体甲生成,甲中可能含有氧化铜、氧化亚铜、硫化铜、硫化亚铜。
查阅资料:
①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在空气中充分煅烧,可以转化为氧化铜。
②硫化铜和硫化亚铜常温下都不溶于稀盐酸,在空气中充分煅烧,均转化为氧化铜和二氧化硫。
为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如下实验:
(3)、步骤②中检验滤渣是否洗涤干净的实验方法是: 。
(4)、固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有:
。
(5)、确定乙是否煅烧完全的操作是: 。
(6)、煅烧过程中一定发生的化学反应方程式为: 。
高氯酸铵(NH4ClO4)是复合火箭推进剂的重要成分,实验室可通过下列反应制取:
NaClO4(aq)+NH4Cl(aq) NH4ClO4(aq)+NaCl(aq)
(7)、用氨气和浓盐酸代替NH4Cl,上述反应不需要外界供热就能进行,其原因是:
。
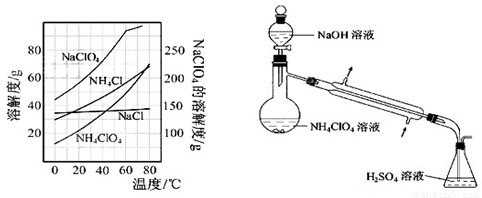
(8)、反应得到的混合溶液中NH4ClO4和NaCl的质量分数分别为0.30和0.l5(相关物质的溶解度曲线如下图)。从混合溶液中获得较多NH4ClO4晶体的实验操作依次为(填操作名称)蒸发浓缩, ,过滤, 、干燥。
为了测定样品中NH4ClO4的含量,装置如上图所示(加热装置、仪器固定装置已略去),实验步骤如下:

(9)、步骤3中,准确取用24.00 mL H2SO4(aq)的玻璃仪器是 。
(10)、实验中确保生成的氨被稀硫酸完全吸收的实验步骤是 (填写步骤编号)。
(11)、必须重复实验2~3次,其原因是 。
(12)、如果0.320 g试样中含NH4ClO4的准确值为0.095g,而实验测定结果是0.092g 。该实验
的相对误差为 。
为探究铜与浓硫酸的反应,某兴趣小组进行了如下实验。
【实验1】铜与浓硫酸反应,实验装置如图所示。
(1)、装置A中发生反应的化学方程式为:
(2)、熄灭酒精灯后,因为有导管存在,B中的液体不会倒吸,其原因是: 。
拆除装置前,不打开胶塞,为了使装置中的残留气体完全被吸收,应当采取的操作是: 。
【实验2】实验中发现试管内除了产生白色固体外,在铜丝表面还有黑色固体甲生成,甲中可能含有氧化铜、氧化亚铜、硫化铜、硫化亚铜。
查阅资料:
①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在空气中充分煅烧,可以转化为氧化铜。
②硫化铜和硫化亚铜常温下都不溶于稀盐酸,在空气中充分煅烧,均转化为氧化铜和二氧化硫。
为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如下实验:
(3)、步骤②中检验滤渣是否洗涤干净的实验方法是: 。
(4)、固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有:
。
(5)、确定乙是否煅烧完全的操作是: 。
(6)、煅烧过程中一定发生的化学反应方程式为: 。
高氯酸铵(NH4ClO4)是复合火箭推进剂的重要成分,实验室可通过下列反应制取:
NaClO4(aq)+NH4Cl(aq) NH4ClO4(aq)+NaCl(aq)
NH4ClO4(aq)+NaCl(aq)
(7)、用氨气和浓盐酸代替NH4Cl,上述反应不需要外界供热就能进行,其原因是:
。
(8)、反应得到的混合溶液中NH4ClO4和NaCl的质量分数分别为0.30和0.l5(相关物质的溶解度曲线如下图)。从混合溶液中获得较多NH4ClO4晶体的实验操作依次为(填操作名称)蒸发浓缩, ,过滤, 、干燥。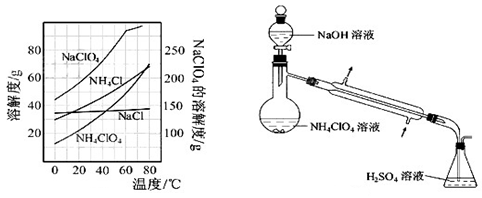
为了测定样品中NH4ClO4的含量,装置如上图所示(加热装置、仪器固定装置已略去),实验步骤如下:
(9)、步骤3中,准确取用24.00 mL H2SO4(aq)的玻璃仪器是 。
(10)、实验中确保生成的氨被稀硫酸完全吸收的实验步骤是 (填写步骤编号)。
(11)、必须重复实验2~3次,其原因是 。
(12)、如果0.320 g试样中含NH4ClO4的准确值为0.095g,而实验测定结果是0.092g。该实验
的相对误差为 。
为探究铜与浓硫酸的反应,某兴趣小组进行了如下实验。
【实验1】铜与浓硫酸反应,实验装置如图所示。
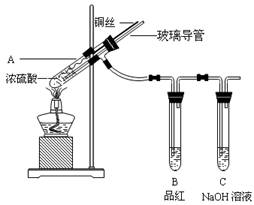
(1)、装置A中发生反应的化学方程式为:
(2)、熄灭酒精灯后,因为有导管存在,B中的液体不会倒吸,其原因是: 。
拆除装置前,不打开胶塞,为了使装置中的残留气体完全被吸收,应当采取的操作是: 。
【实验2】实验中发现试管内除了产生白色固体外,在铜丝表面还有黑色固体甲生成,甲中可能含有氧化铜、氧化亚铜、硫化铜、硫化亚铜。
查阅资料:
①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在空气中充分煅烧,可以转化为氧化铜。
②硫化铜和硫化亚铜常温下都不溶于稀盐酸,在空气中充分煅烧,均转化为氧化铜和二氧化硫。
为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如下实验:
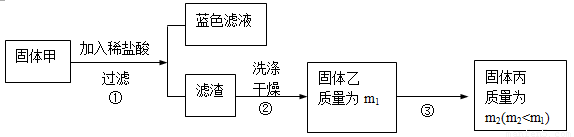
(3)、步骤②中检验滤渣是否洗涤干净的实验方法是: 。
(4)、固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有:
。
(5)、确定乙是否煅烧完全的操作是: 。
(6)、煅烧过程中一定发生的化学反应方程式为: 。
高氯酸铵(NH4ClO4)是复合火箭推进剂的重要成分,实验室可通过下列反应制取:
NaClO4(aq)+NH4Cl(aq) NH4ClO4(aq)+NaCl(aq)
NH4ClO4(aq)+NaCl(aq)
(7)、用氨气和浓盐酸代替NH4Cl,上述反应不需要外界供热就能进行,其原因是:
。
(8)、反应得到的混合溶液中NH4ClO4和NaCl的质量分数分别为0.30和0.l5(相关物质的溶解度曲线如下图)。从混合溶液中获得较多NH4ClO4晶体的实验操作依次为(填操作名称)蒸发浓缩, ,过滤, 、干燥。
为了测定样品中NH4ClO4的含量,装置如上图所示(加热装置、仪器固定装置已略去),实验步骤如下:
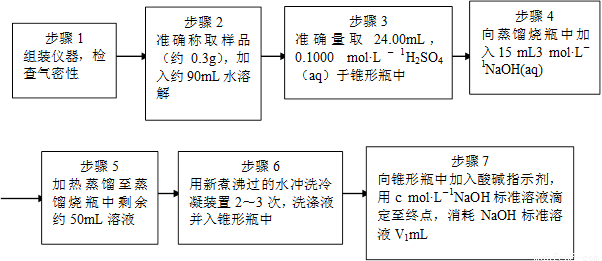
(9)、步骤3中,准确取用24.00 mL H2SO4(aq)的玻璃仪器是 。
(10)、实验中确保生成的氨被稀硫酸完全吸收的实验步骤是 (填写步骤编号)。
(11)、必须重复实验2~3次,其原因是 。
(12)、如果0.320 g试样中含NH4ClO4的准确值为0.095g,而实验测定结果是0.092g 。该实验
的相对误差为 。
 CH2═CH2+H2O),将生成的气体直接通入溴水中,发现溴水褪色,即证明乙烯与溴水发生了加成反应.乙同学发现在甲同学的实验中,产生的气体有刺激性气味,推测在制得的乙烯中还可能含有少量有还原性的杂质气体,由此他提出必须先把杂质气体除去,再与溴水反应.
CH2═CH2+H2O),将生成的气体直接通入溴水中,发现溴水褪色,即证明乙烯与溴水发生了加成反应.乙同学发现在甲同学的实验中,产生的气体有刺激性气味,推测在制得的乙烯中还可能含有少量有还原性的杂质气体,由此他提出必须先把杂质气体除去,再与溴水反应.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com