
题目列表(包括答案和解析)
(8分)(1)常温下,有0.1mol/L的盐酸和0.1mol/L的醋酸溶液,回答下列问题:
①比较两溶液的pH ,盐酸 (填“<” 、“="”" 或 “>”)醋酸,写出醋酸电离的方程式 。
②两种酸均能与氢氧化钠反应生成盐,其中醋酸与氢氧化钠反应能生成醋酸钠,实验室现有部分醋酸钠固体,取少量溶于水,溶液呈 (填“酸性” 、“中性” 或 “碱性”),其原因是(用离子方程式表示) 。
③向醋酸溶液中加入一定量的NaOH溶液,当测得溶液的pH=7时,溶液中离子的浓度大小为
(填字母,下同),当测得溶液的pH<7时,溶液中离子的浓度大小为 。
a.c(Na+)>c(CH3COO—)>c(OH—)>c(H+) b.c(Na+) = c(CH3COO—)>c(OH—) =c(H+)
c.c(CH3COO—)>c(Na+)>c(H+)>c(OH—) d.c(Na+)>c(CH3COO—)>c(H+)>c(OH—)
(2)向盛有1mL0.1mol/LMgCl2溶液的试管中滴加2滴2mol/L NaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,静置。可以观察到的现象是 ,产生该现象的原因是(用离子方程式或文字表示) 。
(8分)(1)常温下,有0.1mol/L的盐酸和0.1mol/L的醋酸溶液,回答下列问题:
①比较两溶液的pH ,盐酸 (填“<” 、“=” 或 “>”)醋酸,写出醋酸电离的方程式 。
②两种酸均能与氢氧化钠反应生成盐,其中醋酸与氢氧化钠反应能生成醋酸钠,实验室现有部分醋酸钠固体,取少量溶于水,溶液呈 (填“酸性” 、“中性” 或 “碱性”),其原因是(用离子方程式表示) 。
③向醋酸溶液中加入一定量的NaOH溶液,当测得溶液的pH=7时,溶液中离子的浓度大小为
(填字母,下同),当测得溶液的pH<7时,溶液中离子的浓度大小为 。
a.c(Na+)>c(CH3COO—)>c(OH—)>c(H+) b.c(Na+) = c(CH3COO—)>c(OH—) =c(H+)
c.c(CH3COO—)>c(Na+)>c(H+)>c(OH—) d.c(Na+)>c(CH3COO—)>c(H+)>c(OH—)
(2)向盛有1mL0.1mol/LMgCl2溶液的试管中滴加2滴2mol/L NaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,静置。可以观察到的现象是 ,产生该现象的原因是(用离子方程式或文字表示) 。
(8分)(1)常温下,有0.1mol/L的盐酸和0.1mol/L的醋酸溶液,回答下列问题:
①比较两溶液的pH ,盐酸 (填“<” 、“=” 或 “>”)醋酸,写出醋酸电离的方程式 。
②两种酸均能与氢氧化钠反应生成盐,其中醋酸与氢氧化钠反应能生成醋酸钠,实验室现有部分醋酸钠固体,取少量溶于水,溶液呈 (填“酸性” 、“中性” 或 “碱性”),其原因是(用离子方程式表示) 。
③向醋酸溶液中加入一定量的NaOH溶液,当测得溶液的pH=7时,溶液中离子的浓度大小为
(填字母,下同),当测得溶液的pH<7时,溶液中离子的浓度大小为 。
a.c(Na+)>c(CH3COO—)>c(OH—)>c(H+) b.c(Na+) = c(CH3COO—)>c(OH—) =c(H+)
c.c(CH3COO—)>c(Na+)>c(H+)>c(OH—) d.c(Na+)>c(CH3COO—)>c(H+)>c(OH—)
(2)向盛有1mL0.1mol/LMgCl2溶液的试管中滴加2滴2mol/L NaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,静置。可以观察到的现象是 ,产生该现象的原因是(用离子方程式或文字表示) 。
(本题8分)(1)在一定体积的密闭容器中,进行如下化学反应:
![]() A(g) + 3B(g) 2C(g) + D(s) ΔH,其化学平衡常数K与温度t的关系如下表:
A(g) + 3B(g) 2C(g) + D(s) ΔH,其化学平衡常数K与温度t的关系如下表:
t/K | 298 | 398 | 498 | … |
K/(mol?L-1)-2 | 4.1×106 | 8.2×107 | K1 | … |
请完成下列问题:
① 该反应的化学平衡常数表达式为K= 。
② 判断该反应的ΔH 0(填“>”或“<”)
③ 在一定条件下,不能判断该反应已达化学平衡状态的是 (填序号)。
A.3v(B)(正)=2v(C)(逆) B.D的物质的量不变
C.容器内压强保持不变 D.混合气体的密度保持不变
④398K、1.01×105Pa在1L的密闭容器中加入1molA和3molB,达平衡时A的转化率为a,在相同条件下的另1L容器中,若要达到与前一容器中相同的气体浓度,则需加入 molC,D的取值范围为 mol。
(2)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。
①写出盐酸肼第一步水解反应的离子方程式 。
②盐酸肼水溶液中离子浓度的排列顺序不正确的是 (填序号)。
A.c(Cl-) > c(N2H62+) > c(H+) > c(OH-)
B.c(Cl-) > c(H+)> c([N2H5?H2O] +) > c(OH-)
C.2 c(N2H62+)+ c([N2H5?H2O] +)+c(H+)= c(Cl-)+c(OH-)
D.c(N2H62+) > c(Cl-) > c(H+) > c(OH-)
(8分)(1)对于下列反应:2SO2(g) + O2(g) 2SO3(g) , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,用O2浓度变化来表示的反应速率为 __________________。
2SO3(g) , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,用O2浓度变化来表示的反应速率为 __________________。
(2)下图表示在密闭容器中反应:2SO2+O2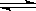 2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是___________________; 请将增大压
2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是___________________; 请将增大压 强时的反应速率变化情况画在c~d处:
强时的反应速率变化情况画在c~d处:
(3)以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内混合气体的平均相对分子质量比原平衡时___________(填“增大”、“减小”或“相等”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com