
题目列表(包括答案和解析)
 SO2是一种重要的化工原料,也是引起酸雨污染的重要来源.
SO2是一种重要的化工原料,也是引起酸雨污染的重要来源.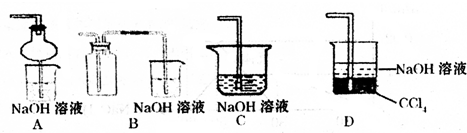
SO2是一种重要的化工原料,也是引起酸雨污染的重要来源。
(1)下列有关酸雨的说法正确的是 (填序号)。
A. SO2、NO2或CO2都会导致酸雨的形成
B. NO不溶于水,所以不会造成酸雨污染
C. 燃煤时鼓入足量空气,可以减少酸雨的产生
D. 采用清洁能源,可以减少酸雨的产生
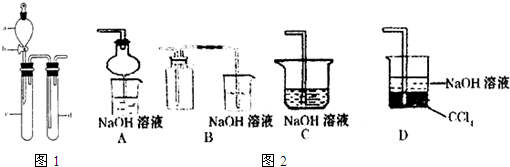
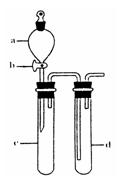
(2)某兴趣小组采用右图装置制取并探究SO2气体的性质。
①下列实验方案适用于用右图所示装置制取所需SO2的是 (填序号)。
A. Na2SO3溶液与HNO3 B. Na2SO3固体与浓硫酸
C. 固体硫在纯氧中燃烧 D.铜与浓H2SO4
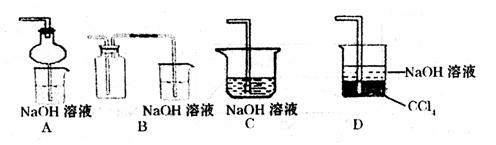
②组装完仪器后,检查装置气密性的方法是:关闭活塞b,
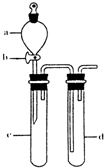
③指导老师指出应增加一尾气吸收装置,并帮助同学们设计了如下装置,其中合理的是
(填序号)。
④小组同学设计在试管d中加入FeCl3溶液,验证SO2的还原性。为了验证SO2与Fe3+发生了氧化还原反应,他们在通入足量SO2后,取试管d中的溶液,分成三份,并设计了如下实验:
方案A:往第一份试液中加入KmnO4溶液,紫红色褪去
方案B:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红
方案C:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是 原因是
(10分)Na2SO3固体在实验室中长期保存易变质。
(1)实验室中欲检验Na2SO3固体样品是否已经变质,最简单的方法为 。
(2)选用以下装置和药品,通过测定生成SO2的质量,可计算m1 gNa2SO3固体样品的纯度。
反应原理:H2SO4(浓)+Na2SO3![]() Na2SO4+SO2↑+H2O
Na2SO4+SO2↑+H2O
供选用的药品:①浓硫酸 ②浓硝酸 ③碱石灰 ④氮气
供选用的装置如下(同一装置可重复选用),将所选仪器按连接顺序从左至右依次填入下表,并填入仪器中对应所加的试剂(不用填A装置中的药品;根据需要填写,可不填满)。
| 实验装置(填字母) | D |
|
| C |
|
|
|
| 装置中所盛药品(填序号) | ④ |
|
|
|
|
|
|
(3)实验结束后,若测得A装置质量减少了m2 g,B装置增重了m3 g,上表中已知的C装置增重了m4 g,则该Na2SO3固体样品的纯度为 。
SO2是一种重要的化工原料,也是引起酸雨污染的重要来源。
(1)下列有关酸雨的说法正确的是 (填序号)。
A. SO2、NO2或CO2都会导致酸雨的形成
B. NO不溶于水,所以不会造成酸雨污染
C. 燃煤时鼓入足量空气,可以减少酸雨的产生
D. 采用清洁能源,可以减少酸雨的产生
(2)某兴趣小组采用右图装置制取并探究SO2气体的性质。
①下列实验方案适用于用右图所示装置制取所需SO2的是 (填序号)。
A. Na2SO3溶液与HNO3 B. Na2SO3固体与浓硫酸
C. 固体硫在纯氧中燃烧 D.铜与浓H2SO4
②组装完仪器后,检查装置气密性的方法是:关闭活塞b,
③指导老师指出应增加一尾气吸收装置,并帮助同学们设计了如下装置,其中合理的是
(填序号)。
④小组同学设计在试管d中加入FeCl3溶液,验证SO2的还原性。为了验证SO2与Fe3+发生了氧化还原反应,他们在通入足量SO2后,取试管d中的溶液,分成三份,并设计了如下实验:
方案A:往第一份试液中加入KmnO4溶液,紫红色褪去
方案B:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红
方案C:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是 原因是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com