
题目列表(包括答案和解析)
(16分,每空2分)用质量分数为98%,密度为1.84 g•cm-3的浓硫酸配制100mL物质的量浓度为1mol/L的稀硫酸。
(1)需要使用的主要仪器有量筒、烧杯、玻璃棒、 、 。
(2)其操作步骤可分解为以下几步:
A.用量筒量取 mL浓硫酸,缓缓注入装有约50mL蒸馏水的烧杯里,并用玻璃棒搅拌
B.用约30mL蒸馏水分三次洗涤烧杯和玻璃棒,将每次的洗液都倒入容量瓶里
C.将稀释后的硫酸小心地用玻璃棒引流容量瓶里
D.检查100mL容量瓶,是否漏水
E.将蒸馏水直接加入容量瓶,至液面接近刻度线
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,到液面最低点恰好与刻线相切
请据此填写:
①完成上述步骤中的空白处。
②正确的操作顺序是(用字母填写):
( )→( )→( )→( )→( )→( )→( )。
③进行A步操作时,选用量筒的规格是 。(选填字母)
A.10mL B.50mL C.100mL D.1000mL
④如果对装有浓硫酸的量筒仰视读数,配制的稀硫酸浓度将 (选填“偏高”、“偏低”、“无影响”)。
⑤A步骤操作完成时,必须 后,才能进行后面的操作。
(16分,每空2分)(1)已知丙酮[ CH3COCH3 ]键线式可表示为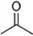 根据键线式回答下列问题:
根据键线式回答下列问题: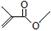 分子式: ,结构简式:
分子式: ,结构简式:
(2)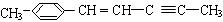 分子中最多有 个原子共直线;最多有 个原子共平面
分子中最多有 个原子共直线;最多有 个原子共平面
(3)有机物CH3CH(C2H5)CH(CH3)2的名称是
(4)写出由苯丙烯( 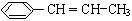 )在催化剂作用下生成聚苯丙烯的反应方程式:
)在催化剂作用下生成聚苯丙烯的反应方程式:
(5)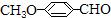 有多种的同分异构体,其中属于芳香族羧酸的同分异构体共有4种,它们的结构简式是: 、 、(任写其中二种)
有多种的同分异构体,其中属于芳香族羧酸的同分异构体共有4种,它们的结构简式是: 、 、(任写其中二种)
(16分,每空2分)某工厂的工业废水中含有大量的FeSO4,较多的CuSO4和少量Na2SO4。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据下列流程图,完成回收硫酸亚铁和铜的实验方案。(可供选择的试剂为铁粉、稀H2SO4、NaOH溶液等试剂)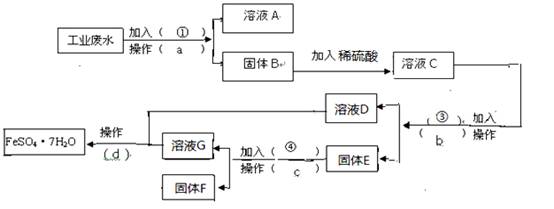 (1)操作a的名称为
,所需要的玻璃仪器为
____。
(1)操作a的名称为
,所需要的玻璃仪器为
____。
(2)固体E的成分为 ____,加入的试剂④为 __,发生的化学方程式为 。
(3)加入试剂①的目的是 ____________。
(4)从溶液D和溶液G中得到FeSO4.7H2O晶体的操作为 、冷却结晶 、
、洗涤、干燥。
(16分,每空2分)某工厂的工业废水中含有大量的FeSO4,较多的CuSO4和少量Na2SO4。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据下列流程图,完成回收硫酸亚铁和铜的实验方案。(可供选择的试剂为铁粉、稀H2SO4、NaOH溶液等试剂)(1)操作a的名称为 ,所需要的玻璃仪器为 ____。
(2)固体E的成分为 ____,加入的试剂④为 __,发生的化学方程式为 。
(3)加入试剂①的目的是 ____________。
(4)从溶液D和溶液G中得到FeSO4.7H2O晶体的操作为 、冷却结晶 、
、洗涤、干燥。
(16分,每空2分)某工厂的工业废水中含有大量的FeSO4,较多的CuSO4和少量Na2SO4。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据 下列流程图,完成回收硫酸亚铁和铜的实验方案。(可供选择的试剂为铁粉、稀H2SO4、
下列流程图,完成回收硫酸亚铁和铜的实验方案。(可供选择的试剂为铁粉、稀H2SO4、 NaOH溶液等试剂)
NaOH溶液等试剂)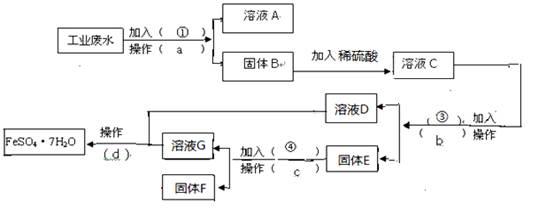 (1)操作a的名称为 ,所需要的玻璃仪器为 ____。
(1)操作a的名称为 ,所需要的玻璃仪器为 ____。
(2)固体E的成分为  ____,加入的试剂④为 __,发生的化学方程式为 。
____,加入的试剂④为 __,发生的化学方程式为 。
(3)加入试剂①的目 的是 ____________。
的是 ____________。
(4)从溶液D和溶液G中得到FeSO4.7H2O晶体的操作为 、冷却结晶 、
、洗涤、干燥。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com