
题目列表(包括答案和解析)
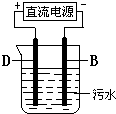
(15分) ![]() I.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
I.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
![]()
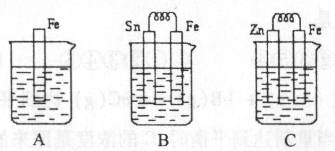
(1)A中反应的离子方程式为 ;
(2)B中Sn极的电极反应式为 ,Sn极附近溶液的pH (填“增大”、“减小”或“不变”);
(3)C中被腐蚀的金属是 ,总反应式为 比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是
II.现有常温下的6份溶液:①0.01 mol?L-1CH3COOH溶液;②0.01 mol?L-1HCl溶液;③pH=13的氨水;④pH=13的NaOH溶液;⑤0.01 mol? L-1CH3COOH溶液与pH=12的NaOH等体积混合后所得溶液;⑥0.01 mol?L-1HCI溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)其中水的电离程度最大的是 (选填序号,下同),水的电离程度相同的是 ;
(2)若将②、④混合后所得溶液pH=12,则消耗②、④溶液的体积之比为 ;
(3)将溶液同等稀释10倍后溶液的pH:③ ④,⑤ ⑥(选填“>”或“<”或“=”)。
 现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.

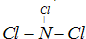
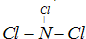

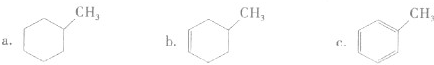
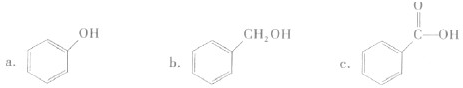
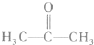



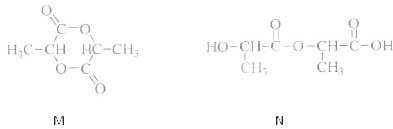

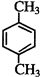
 的同系物; d.A、B、C、D常温下均为气体
的同系物; d.A、B、C、D常温下均为气体
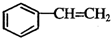
 或
或
 或
或
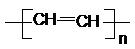
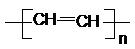
 (2009?湖北模拟)现有A、B、C、D四种元素,其原子序数依次递增.已知,A、C为短周期非金属元素,其单质在常温下均为气体,两单质混合见光爆炸生成AC,AC溶液显强酸性.B、D为金属元素,B的原子序数为D的一半,D与C2和AC溶液反应分别得DC3和DC2,烧碱溶液不能与D单质反应,而能与B单质反应.请回答下列问题:
(2009?湖北模拟)现有A、B、C、D四种元素,其原子序数依次递增.已知,A、C为短周期非金属元素,其单质在常温下均为气体,两单质混合见光爆炸生成AC,AC溶液显强酸性.B、D为金属元素,B的原子序数为D的一半,D与C2和AC溶液反应分别得DC3和DC2,烧碱溶液不能与D单质反应,而能与B单质反应.请回答下列问题: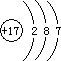

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com