
题目列表(包括答案和解析)
Ⅰ.某溶液中仅含下表离予中的5种离子(不考虑水的电离及离子的水解),且各离子的物质的量均相等都为0.0lmol。
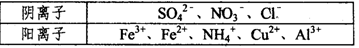
①若向原溶液中加入KSCN溶液,无明显变化。
②若向原溶液中加入过量的盐酸,有气体生成.溶液中阴离子种类不变。
③若向原溶液中加入BaCl2溶液,有白色沉淀生成。
试回答下列问题
(1)若先向原溶液中先加入过量的盐酸,再加入KSCN溶液,现象是__________________。该过程中涉及的离子方程式有________________、__________________。
(2)向原溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体为____________________(写化学式)。
(3)向原溶液中加入足量盐酸后,用排水法收集所产生的气体并使气体恰好充满容器,将容器倒置于水槽中,再向容器中通入___________mLO2(气体体积均指标准状况),能使溶液充满该容器。
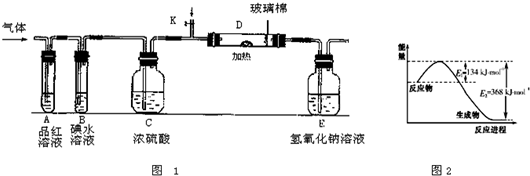
Ⅱ.amolCu2S和bmol FeS投入到v L c mol/L的稀硝酸中;充分反应,生成NO气体,所得澄清溶液可以看作Cu(NO3)2、Fe(NO3)3和H2SO4的混合溶液,则反应中未被还原的硝酸的物质的量为 ___________mol(用同时含有a、b、v、c的表达式表示)。
Ⅲ.已知CH4(g)+2O2(g)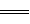 CO2(g)+2H2O(l) △H1=a kJ/mol欲计算反应CH4(g)+4NO(g)
CO2(g)+2H2O(l) △H1=a kJ/mol欲计算反应CH4(g)+4NO(g)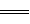 2N2(g)+CO2(g)+2H2O(l)的焓变△H2,则还需要查找某反应的焓变△H3,当反应中各物质化学计量数之比为最简整数比时△H3=b kJ/mol,则该反应的热化学方程式为______________________________________。
2N2(g)+CO2(g)+2H2O(l)的焓变△H2,则还需要查找某反应的焓变△H3,当反应中各物质化学计量数之比为最简整数比时△H3=b kJ/mol,则该反应的热化学方程式为______________________________________。
据此计算出△H2=_____________kJ/mol(用含a和b的式子表示)。
Ⅰ.某溶液中仅含下表离予中的5种离子(不考虑水的电离及离子的水解),且各离子的物质的量均相等都为0.0lmol。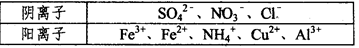
①若向原溶液中加入KSCN溶液,无明显变化。
②若向原溶液中加入过量的盐酸,有气体生成.溶液中阴离子种类不变。
③若向原溶液中加入BaCl2溶液,有白色沉淀生成。
试回答下列问题
(1)若先向原溶液中先加入过量的盐酸,再加入KSCN溶液,现象是__________________。该过程中涉及的离子方程式有________________、__________________。
(2)向原溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体为____________________(写化学式)。
(3)向原溶液中加入足量盐酸后,用排水法收集所产生的气体并使气体恰好充满容器,将容器倒置于水槽中,再向容器中通入___________mLO2(气体体积均指标准状况),能使溶液充满该容器。
Ⅱ.amolCu2S和bmol FeS投入到v L c mol/L的稀硝酸中;充分反应,生成NO气体,所得澄清溶液可以看作Cu(NO3)2、Fe(NO3)3和H2SO4的混合溶液,则反应中未被还原的硝酸的物质的量为 ___________mol(用同时含有a、b、v、c的表达式表示)。
Ⅲ.已知CH4(g)+2O2(g) CO2(g)+2H2O(l) △H1=a kJ/mol欲计算反应CH4(g)+4NO(g)
CO2(g)+2H2O(l) △H1=a kJ/mol欲计算反应CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(l)的焓变△H2,则还需要查找某反应的焓变△H3,当反应中各物质化学计量数之比为最简整数比时△H3=b kJ/mol,则该反应的热化学方程式为______________________________________。
2N2(g)+CO2(g)+2H2O(l)的焓变△H2,则还需要查找某反应的焓变△H3,当反应中各物质化学计量数之比为最简整数比时△H3=b kJ/mol,则该反应的热化学方程式为______________________________________。
据此计算出△H2=_____________kJ/mol(用含a和b的式子表示)。
(1)将盛有等物质的量浓度3 mol/L体积均为150 mL的稀硫酸的两个烧杯分别置于托盘天平上,调节天平使之平衡,然后在两个烧杯中分别加入质量均为m g的铝和镁.要求反应后天平仍平衡,则m必须满足________(不要求计算过程)
(2)6.4 g Cu与过量的8 mol/L 30 mL HNO3反应,硝酸的还原产物为NO2和NO,反应结束后测得溶液中n(H+)为a mol,则溶液中所含n(NO3-)为________.

| ||
| ||
CuSO4·5H2O是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。
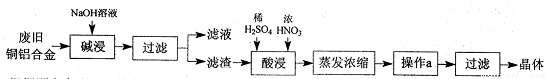
根据题意完成下列填空:
(1)“碱浸”的目的是 ,写出有关的离子方程式 。
(2)向滤渣中先加入足量稀硫酸,然后再滴加少量浓硝酸,在废渣溶解时可以观察到的实验现象有 。
(3)操作a的名称为 ,制得的CuSO4·5H2O中可能存在硝酸铜杂质,除去这种杂质的实验操作名称为 。
(4)已知:CuSO4+2NaOH=Cu(OH)2↓+ Na2SO4。称取0.26 g提纯后的CuSO4·5H2O试样于锥形瓶中,加入0.1000 mol/L氢氧化钠溶液28.00 mL,反应完全后,过量的氢氧化钠用0.1000 mol/L盐酸滴定至终点,耗用盐酸8.00 mL,则该试样中CuSO4·5H2O的质量分数为 ;上述滴定中,滴定管在注入盐酸之前,先用蒸馏水洗净,再用 。
(5)在“酸浸”的步骤中,①若只加入浓硫酸,写出加热时的化学方程式 。
②若将浓硝酸换成过氧化氢,常温时即可生成硫酸铜,指出此种方法的优点 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com