
题目列表(包括答案和解析)
(10分)等质量的两种金属粉末A、B分别与同浓度的足量稀盐酸反应,都生成+2价金属氯化物,其反应情况如图所示:
(1 ) 两种金属的活动性顺序是_____>______
) 两种金属的活动性顺序是_____>______
两种金属氯化物的摩尔质量是_____>______
(2) 将两种金属粉末按一定比例混合后,进行甲、乙
丙三组实验,三组实验各取500mL同浓度的盐酸
溶液加入该种混合粉末,产生气体,有关数据如下:
| 实验序号 | 甲 | 乙 | 丙 |
| 混合粉末质量(g) | 6.2 | 18.6 | 24.8 |
| 生成气体气体(mL) | 2240 | 5600 | 5600 |
(10分)等质量的两种金属粉末A、B分别与同浓度的足量稀盐酸反应,都生成+2价金属氯化物,其反应情况如图所示:
(1) 两种金属的活动性顺序是_____>______
两种金属氯化物的摩尔质量是_____>______
(2) 将两种金属粉末按一定比例混合后,进行甲、乙 丙三组实验,三组实验各取500mL同浓度的盐酸 溶液加入该种混合粉末,产生气体,有关数据如下:
|
实验序号 |
甲 |
乙 |
丙 |
|
混合粉末质量(g) |
6.2 |
18.6 |
24.8 |
|
生成气体气体(mL) |
2240 |
5600 |
5600 |
①乙组实验中,盐酸________(填“过量”、“适量”或“不足量”)
②上述所用的盐酸的物质的量浓度为_____mol/L,混合粉末的平均摩尔质量是________。
(10分)等质量的两种金属粉末A、B分别与同浓度的足量稀盐酸反应,都生成+2价金属氯化物,其反应情况如图所示:
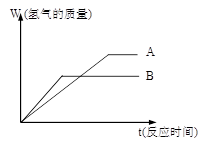
(1) 两种金属的活动性顺序是_____>______
两种金属氯化物的摩尔质量是_____>______
(2) 将两种金属粉末按一定比例混合后,进行甲、乙 丙三组实验,三组实验各取500mL同浓度的盐酸 溶液加入该种混合粉末,产生气体,有关数据如下:
| 实验序号 | 甲 | 乙 | 丙 |
| 混合粉末质量(g) | 6.2 | 18.6 | 24.8 |
| 生成气体气体(mL) | 2240 | 5600 | 5600 |
①乙组实验中,盐酸________(填“过量”、“适量”或“不足量”)
②上述所用的盐酸的物质的量浓度为_____mol/L,混合粉末的平均摩尔质量是________。
(10分)等质量的两种金属粉末A、B分别与同浓度的足量稀盐酸反应,都生成+2价金属氯化物,其反应情况如图所示: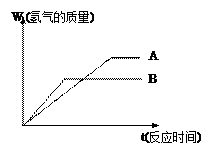
(1) 两种金属的活动性顺序是_____>______
两种金属氯化物的摩尔质量是_____>______
(2) 将两种金属粉末按一定比例混合后,进行甲、乙 丙三组实验,三组实验各取500mL同浓度的盐酸 溶液加入该种混合粉末,产生气体,有关数据如下:
| 实验序号 | 甲 | 乙 | 丙 |
| 混合粉末质量(g) | 6.2 | 18.6 | 24.8 |
| 生成气体气体(mL) | 2240 | 5600 | 5600 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com