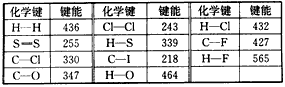
化学键的键能是指气态原子间形成1mol化学键时释放的能量。如:H(g)+I(g)→H-I(g)+297kJ 即H-I键的键能为297kJ·mol-1,也可以理解为破坏1mol H-I键需要吸收297kJ的热量。化学反应的发生可以看成旧化学键的破坏和新化学键的形成。下表是一些键能数据:(单位:kJ/mol)
阅读上述信息,回答下列问题:
(1)根据表中数据判断CCl4的稳定性____(填“大于”或“小于”)CF4的稳定性。试预测C-Br键的键能范 围____<C-Br键能<____。
(2)结合表中数据和热化学方程式H2(g)+Cl2(g)=2HCl(g) △H=-QkJ/mol;通过计算确定热化学方程式中Q的值为________。由热化学方程式2H2(g)+S2(s)=2H2S(g) △H=-224. 5kJ/mol,以及表中数值可计算出1mol
S2(s)气化时将____(填“吸收”或“放出”)____kJ热量。
(3)共价键的极性强弱对化学反应有很大的影响。卤代烃RX在同样条件下发生碱性水解反应时,RF、
RCl、RBr、RI(R相同)的反应活性由大到小的顺序是____________。
(4)有人认为:H-O键的键能大于H-S键的键能,所以H2O的熔沸点高于H2S的熔沸点。你是否赞同这种观点?如不赞同,请说出你的解释:________________。
(5)由表中数据能否得出这样的结论:
①半径越小的原子形成的共价键越牢固(即键能越大)______(填“能”或“不能”)。
②非金属性越强的原子形成的共价键越牢固____(填“能”或“不能”)。能否从数据找出一些规律,请写出一条:________________。