(2011?镇江一模)工业碳酸钠(纯度约为98%)中含有Ca
2+、Mg
2+、Fe
3+、Cl
-和SO
42-等杂质,提纯工艺线路如下:
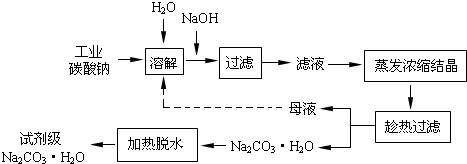
Ⅰ、碳酸钠的饱和溶液在不同温度下析出的溶质如图所示:
Ⅱ、25℃时有关物质的溶度积如下:
| 物质 |
CaCO3 |
MgCO3 |
Ca(OH)2 |
Mg(OH)2 |
Fe (OH)3 |
| Ksp |
4.96×10-9 |
6.82×10-6 |
4.68×10-6 |
5.61×10-12 |
2.64×10-39 |
回答下列问题:
(1)加入NaOH溶液时发生的离子方程式为
Fe3++3OH-=Fe(OH)3↓,MgCO3+2OH-=Mg(OH )2↓+CO32-
Fe3++3OH-=Fe(OH)3↓,MgCO3+2OH-=Mg(OH )2↓+CO32-
.25℃时,向含有Mg
2+、Fe
3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg
2+):c(Fe
3+)=
2.215×1021
2.215×1021
.
(2)“趁热过滤”时的温度应控制在
高于36℃
高于36℃
.
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线所示进行循环使用.请你分析实际工业生产中是否可行
不可行
不可行
,并说明理由
若“母液”循环使用,则溶液c(Cl-)和c(SO42-)增大,最后所得产物Na2CO3中混有杂质
若“母液”循环使用,则溶液c(Cl-)和c(SO42-)增大,最后所得产物Na2CO3中混有杂质
.
(4)已知:Na
2CO
3?10H
2O(s)=Na
2CO
3(s)+10H
2O(g)△H=+532.36kJ?mol
-1Na
2CO
3?10H
2O(s)=Na
2CO
3?H
2O(s)+9H
2O(g)△H=+473.63kJ?mol
-1写出Na
2CO
3?H
2O脱水反应的热化学方程式
)Na2CO3?H2O(s)=Na2CO3(s)+H2O(g)△H=+58.73kJ?mol-1
)Na2CO3?H2O(s)=Na2CO3(s)+H2O(g)△H=+58.73kJ?mol-1
.


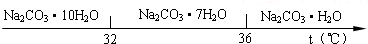
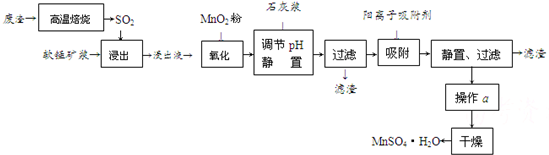
 已知PbO2的氧化性大于MnO2.请回答下列问题:
已知PbO2的氧化性大于MnO2.请回答下列问题: