
题目列表(包括答案和解析)
(14分)I、通过火法冶金炼出的铜是粗铜,含杂质金、银、铁、锌等金属和少量矿物杂质(与酸不反应)。制作电器及其他仪器产品时必须要求是纯铜,为此以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯。
表:几种物质形成沉淀时的pH
物质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
开始沉淀时的pH | 7.6 | 2.7 | 5.7 | 4.7 |
完全沉淀时的pH | 9.7 | 3.7 | 8.5 | 7.3 |
(1)在精炼铜时,阴极电极反应方程式为 ;金、银以单质的形式沉积在电解槽 (填“阳极”或“阴极”)的槽底。
|
①试剂a最好选用 (填写序号),加入试剂a的目的是 。
a、氯水 b、高锰酸钾溶液 c、硝酸 d、双氧水
②操作①是 ,根据上表数据分析,除杂方案中能够除去的杂质金属阳离子是 (填化学式)。
II、重金属离子对河流海洋等会造成严重的污染。某化工厂产生的废水(pH=2.0,密度为1g?mL-1)中含有Ag+、Pb2+等重金属离子,其浓度约为0.01mol?L-1,排放前拟用沉淀法回收这两种金属,查找有关数据如下:
难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
(1)你认为往废水中投入 (填字母序号)沉淀的效果最好
a、NaOH b、Na2S c、KI d、Ca(OH)2
(2)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=
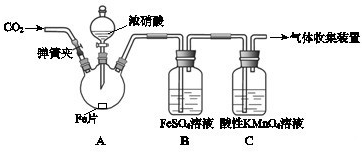
| 实验操作 | 实验现象 |
| 打开弹簧夹,通入一段时间CO2,关闭弹簧夹. | |
| 打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞. | 无明显现象. |
| 加热烧瓶,反应开始后停止加热. | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅; B中溶液变棕色; C中溶液紫色变浅. ②反应停止后,A中无固体剩余. |
(2011?肇庆一模)下表中,对陈述Ⅰ、Ⅱ的正确性及两者间因果关系的判断,完全正确的是( )
|
 (2011?合肥二模)图是各种不同密度的硝酸与铁反应时(相同温度)主要还原产物的分布图.下列叙述不正确的是( )
(2011?合肥二模)图是各种不同密度的硝酸与铁反应时(相同温度)主要还原产物的分布图.下列叙述不正确的是( )湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com