
题目列表(包括答案和解析)
| ||
| ||
|
下列实验操作或实验所得出的结论不正确的说法共有 ①某无色溶液中加入盐酸产生无色无味且能使澄清石灰水变浑浊的气体,则该溶液中一定含有大量CO32- ②分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出 ③配制100 mL 1.00 mol·L-1的NaCl溶液时,可用托盘天平准确称取5.85 g NaCl固体 ④向煮沸的1 mol·L-1氢氧化钠溶液中滴加FeC13饱和溶液可制备氢氧化铁胶体 | |
| [ ] | |
A. |
1个 |
B. |
2个 |
C. |
3个 |
D. |
4个 |
| 物质 | 熔点(℃) | 沸点(℃) | 密度(g/cm3) |
| 乙醇 | -117.0 | 78.0 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸(98%) | - | 338.0 | 1.84 |
| 浓硫酸 |
| 加热 |
| 浓硫酸 |
| 加热 |
| ||
| ||

物质 | 熔点/℃ | 沸点/℃ | 密度/(g/cm2) |
乙醇 | -144 | 78.0 | 0.789 |
乙酸 | 16.6 | 117.9 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.009 |
浓H2SO4(98%) | — | 338 | 1.84 |

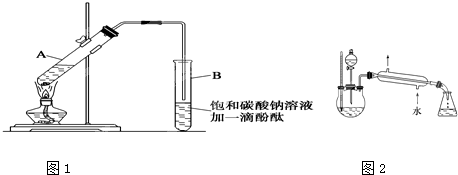
实验室制乙酸乙酯的主要步骤如下:①在20×
(1)步骤①中配制混合液时,向试管中加入三种试剂的顺序_______;
(2)如果使用的乙醇用18O标记,写出化学反应方程式____________________________;
(3)步骤②中必须用小火加热是依据表中的__________组数据;
A.熔点 B.沸点 C.密度
(4)步骤③在振荡前后观察到的现象是__________;
A.上层液体厚度变薄 B.下层液体红色变浅或无色
C.有气体产生 D.有果香味
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com