
题目列表(包括答案和解析)
|
下列物质在常温下发生水解反应的离子方程式正确的是 | |
| [ ] | |
A. |
|
B. |
CH3COONa:CH3COO-+H2O |
C. |
CuSO4:Cu2++2H2O |
D. |
NaF:F-+H2O |
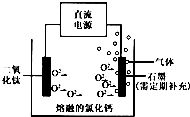 常温下钛的化学活性很小,在较高温度下可与多种物质反应.
常温下钛的化学活性很小,在较高温度下可与多种物质反应.
| >400℃ | 约1250℃ |
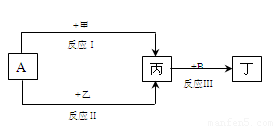
在下列物质转化关系中,反应的条件和部分产物已略去。其中A为常用的溶剂,B为常见的有色气体单质。
回答下列问题:
Ⅰ.若甲、乙是两种常见金属,反应Ⅲ是工业制盐酸的反应。
(1)反应Ⅰ中,甲在通常条件下和A剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,则工业上生产甲的一般方法是 。
A.热分解法 B.热还原法 C.电解法
(2)反应Ⅱ中,乙与A在高温下反应,除丙外,还生成一种有磁性的物质,则反应Ⅱ的化学方程式是 。
(3)通过比较反应Ⅰ、Ⅱ的反应条件,可得出甲的金属性比乙的金属性 (填“强”或“弱”),比较二者金属性强弱的依据还可以是 (写出一种即可)。
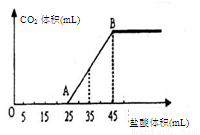
(4)将2.5g甲的碳酸盐、碳酸氢盐和氢氧化物的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:
①写出OA段所发生反应的离子方程式 。
②当加入35mL盐酸时,产生CO2的体积为 mL(标准状况)。
Ⅱ.若甲、乙是化合物,反应Ⅲ是工业制漂白液的反应,其中乙为非极性键的离子化合物,写出A与乙反应的化学方程式 ;
在下列物质转化关系中,反应的条件和部分产物已略去。其中A为常用的溶剂,B为常见的有色气体单质。
回答下列问题:
Ⅰ.若甲、乙是两种常见金属,反应Ⅲ是工业制盐酸的 反应。
反应。
(1)反应Ⅰ中,甲在通常条件下和A剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,则工业上生产甲的一般方法是 。
A.热分解法 B.热还原法 C.电解法
(2)反应Ⅱ中,乙与A在高温下反应,除丙外,还生成一种有磁性的物质,则反应Ⅱ的化学方程式是 。
(3)通过比较反应Ⅰ、Ⅱ的反应条件,可得出甲的金属性比乙的金属性 (填“强”或“弱”),比较二者金属性强弱的依据还可以是 (写出一种即可)。
(4)将2.5g甲的碳酸盐、碳酸氢盐和氢氧化物的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:
①写出OA段所发生反应的离子方程式 。
②当加入35mL盐酸时,产生CO2的体积为 mL(标准状况)。
Ⅱ.若甲、乙是化合物,反应Ⅲ是工业制漂白液的反应,其中乙为非极性键的离子化合物,写出A与乙反应的化学方程式 ;
在下列物质转化关系中,反应的条件和部分产物已略去。其中A为常用的溶剂,B为常见的有色气体单质。
回答下列问题:
Ⅰ.若甲、乙是两种常见金属,反应Ⅲ是工业制盐酸的反应。
(1)反应Ⅰ中,甲在通常条件下和A剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,则工业上生产甲的一般方法是 。
A.热分解法 B.热还原法 C.电解法
(2)反应Ⅱ中,乙与A在高温下反应,除丙外,还生成一种有磁性的物质,则反应Ⅱ的化学方程式是 。
(3)通过比较反应Ⅰ、Ⅱ的反应条件,可得出甲的金属性比乙的金属性 (填“强”或“弱”),比较二者金属性强弱的依据还可以是 (写出一种即可)。
(4)将2.5g甲的碳酸盐、碳酸氢盐和氢氧化物的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:
①写出OA段所发生反应的离子方程式 。
②当加入35mL盐酸时,产生CO2的体积为 mL(标准状况)。
Ⅱ.若甲、乙是化合物,反应Ⅲ是工业制漂白液的反应,其中乙为非极性键的离子化合物,写出A与乙反应的化学方程式 ;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com