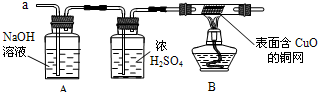
请你参与下列探究:
【问题情景】某化学实验小组同学将铁粉投入硫酸铜溶液中,发现生成红色固体物质的同时有较多的气泡放出.这一现象激发起同学们的探究欲望,生成的是什么气体?
【提出猜想】从物质组成元素的角度,放出的气体可能是SO
2、O
2、H
2.
【查阅资料】SO
2易溶于水,它能与NaOH反应,生成Na
2SO
3.
【方案设计】依据上述猜想,实验小组同学分别设计了如下方案:
(1)甲同学认为是O
2,则检验方法是______.
(2)乙同学认为是SO
2,则只需将放出的气体通入盛有NaOH溶液的洗气瓶中,称量通气前后洗气瓶的质量.写出SO
2与NaOH反应的化学方程式______.
(3)实验小组同学合作设计了如下组合实验方案,排除和验证猜想的气体.
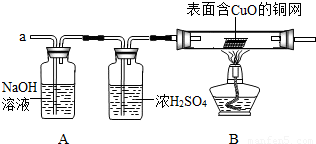
如果放出的是O
2和H
2,你认为方案中的安全隐患是______.
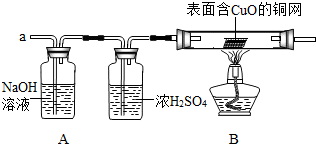
丙同学认为:为确保安全,实验前应先收集一试管气体,用拇指______,若不发出______,方可采用上面的装置进行实验.
【实验探究】经丙同学确认安全后,小组同学首先对装置A进行称量,再将收集到的气体从a通入,过一会儿点燃B处酒精灯;一段时间后,发现表面含CuO的铜网由黑色变为光亮的红色;停止通气,再次称量装置A,发现质量无增减.
结论:铁粉与硫酸铜溶液反应时,产生的气体是______.
【思维拓展】
(1)由上述实验可以推出,硫酸铜溶液中可能含有______物质.
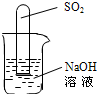
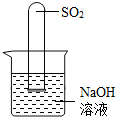
(2)不通过称量,如何判断SO
2与NaOH溶液发生了反应呢?有一同学设计了右图所示的装置进行实验,发现试管内液面上升,就得出SO
2与NaOH溶液发生反应的结论.其他同学认为这一方案不严谨,理由是
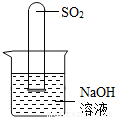
______.要得到科学严谨的结论,仍利用该装置,补做的实验是______.
CuSO
4溶液对过氧化氢的分解具有催化作用.有同学想猜想其他盐溶液也能在这个反应中起到同样的作用,于是他们做了以下的探究:
(1)清你帮助他们完成实验报告:
| 实验过程 | 实验现象 | 实验结论 |
| 在一支试管中加入5ml5%的H2O2溶液,然后滴入适量的FeCl3溶液,把带火星的木条伸入试管. | ______ | FeCl3溶液可以催化分解H2O2 |
(2)已知FeCl
3在水中可分离出Fe
3+和Cl
-,同学们提出以下猜想:
①甲同学的猜想:真正催化分解H
2O
2的是FeCl
3溶液中的H
2O;
②乙同学的猜想:真正催化分解H
2O
2的是FeCl
3溶液中的Fe
3+;
③丙同学的猜想:真正催华分解 H
2O
2的是FeCl
3溶液中的Cl
-;
你认为最不可能的是______同学的猜想,理由是______.
(3)同学们对余下的两个猜想,用实验进行了探究.请你仔细分析后填表:
| 实验过程 | 实验现象 | 实验结论 |
| 向盛有5ml5%的H2O2溶液的试管中加入少量的HCl,并把带火星的木条伸入试管 | 无明显现象 | ______ |
| 向盛有5ml5%的H2O2溶液的试管中加入少量的______,并把带火星的木条伸入试管 | ______ | ______ |
用18mol/L的硫酸配置100ml 1.0mol/L的稀硫酸,若实验仪器有:
A.100ml量筒 B.托盘天平 C.玻璃棒 D.50ml容量瓶
E.10ml量筒 F.胶头滴管 G.50ml烧杯 H.100ml容量瓶
(1)实验时应选用仪器的先后顺序是(填入编号)______.
(2)在容量瓶的使用方法中,下列操作不正确的是(填写编号)______.
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配置溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1cm-2cm处,用滴管滴加蒸馏水到标线.
D.配置溶液时,如果试样是液体,用量筒量取后直接倒入容量瓶中,缓慢加入蒸馏水到接近标线1cm-2cm处,用滴管加入蒸馏水到标线.
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次.




 ______.要得到科学严谨的结论,仍利用该装置,补做的实验是______.
______.要得到科学严谨的结论,仍利用该装置,补做的实验是______.
 ______.要得到科学严谨的结论,仍利用该装置,补做的实验是______.
______.要得到科学严谨的结论,仍利用该装置,补做的实验是______.