
题目列表(包括答案和解析)
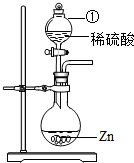 (2011?扬州)某学习小组对硫酸进行如下研究:
(2011?扬州)某学习小组对硫酸进行如下研究:| 时间/h | 1 | 1.5 | 4 | 8 | 12 | 24 | 48 | 60 | |
| 吸水质量/g | 浓硫酸 | 1.6 | 2.2 | 6.2 | 10.3 | 14.0 | 20.9 | 29.2 | 32.1 |
| 稀硫酸 | 1.2 | 1.5 | 3.5 | 5.9 | 8.1 | 12.9 | 19.5 | 21.0 | |
| v×1.84g/cm3×98% |
| v×1.84g/cm3+v×1g/cm3 |
| v×1.84g/cm3×98% |
| v×1.84g/cm3+v×1g/cm3 |
 实验探究让化学更具魅力,请帮助完成下列实验探究
实验探究让化学更具魅力,请帮助完成下列实验探究| 白色粉末的成分 | 形 成 的 原 因 |
| 可能是CaCO3 | 石灰水与空气中CO2反应: 化学方程式为: CO2+Ca(OH)2=CaCO3↓+H2O CO2+Ca(OH)2=CaCO3↓+H2O |
| 可能是 Ca(OH)2 Ca(OH)2 |
随着气温的升高,溶质的溶解度会 变小 变小 填变大或变小)或溶剂蒸发,石灰水中的溶质析出 |
| 实 验 步 骤 | 可能观察到的现象 | 结 论 |
| 取上述试管中的上层清液,滴加1~2滴无色酚酞试液 | 溶液变红 | 白色粉末中含Ca(OH)2 白色粉末中含Ca(OH)2 |
| 往上述试管内残留的固体中加入稀盐酸 | 产生气泡 产生气泡 |
白色粉末中含有CaCO3 |
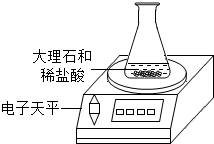
| 时间/分 | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 |
| 大理石碎屑生成的CO2质量/克 | 0 | 1.45 | 1.75 | 1.98 | 2.18 | 2.30 | 2.36 | 2.40 | 2.40 | 2.40 |
| 块状大理石生成的CO2质量/克 | 0 | 0.45 | 0.80 | 1.10 | 1.36 | 1.60 | 1.81 | 1.98 | 2.11 | 2.20 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com