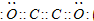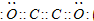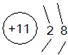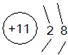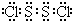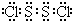
现有A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,D与E同主族,且D的氢化物常温时为液态.A、B的最外层电子数之和与C的最外层电子数相等,A分别与B、C、D形成电子总数相等的分子.
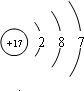
(1)C的元素符号是
N
N
;B的最高价氧化物的电子式为
;元素F在周期表中的位置
第三周期第ⅦA族
第三周期第ⅦA族
.
(2)B、C、D元素的氢化物的沸点由商到低的顺序为
H2O>NH3>CH4
H2O>NH3>CH4
(用化学式表示).
(3)将足量D的单质通入到A
2E的溶液中,反应的化学方程式为
2H2S+O2=2S↓+2H2O
2H2S+O2=2S↓+2H2O
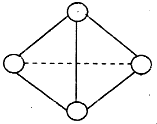
(4)最近意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的C
4气态分子.C
4分子结构如图所示,已知断裂1molC-C吸收l67KJ的热量,生成1mol C≡C放出942KJ热量.试写出由C
4气态分子变成C
2气态分子的热化学方程式:
N4(g)=2N2(g)△H=-882kJ/mol
N4(g)=2N2(g)△H=-882kJ/mol
.
(5)某盐x(C
2A
6F
2)的性质与CA
4F类似,是离子化合物,其水溶液因分步水解而呈弱酸性.
①盐x显酸性原因(用离子方程式表示)
N2H62++H2O?[N2H5?H2O]++H+
N2H62++H2O?[N2H5?H2O]++H+
.
②写出足量金属镁加入盐x的溶液中产生H
2的记学方程式为
Mg+N2H6Cl2=MgCl2+N2H4+H2↑
Mg+N2H6Cl2=MgCl2+N2H4+H2↑
.

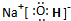
 现有A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,D与E同主族,且D的氢化物常温时为液态.A、B的最外层电子数之和与C的最外层电子数相等,A分别与B、C、D形成电子总数相等的分子.
现有A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,D与E同主族,且D的氢化物常温时为液态.A、B的最外层电子数之和与C的最外层电子数相等,A分别与B、C、D形成电子总数相等的分子.