
题目列表(包括答案和解析)
(1)我国首创以E(单质)—(空气,海水)—石墨(C)电池为能源的新型海水标志灯。该灯以海水为电解质溶液,靠空气中的氧气使E(单质)不断氧化而产生电流。只要把灯放入海水中数分钟,就会发出耀眼的白光,其能量比干电池高20—50倍。该电池的正极反应式是________________________________________________。
(2)将过量气体AF通入AgNO3溶液中得到白色沉淀,将此白色沉淀分成4等份并分别溶于下列物质中:①10 mL水 ②10 mL 0.1 mol·L-1的NaCl溶液 ③10 mL 0.1 mol·L-1的MgCl2溶液 ④10 mL 0.1 mol·L-1的KI溶液。则所得溶液中剩余白色固体质量由大到小的顺序为(填序号)________________________________________________。
(3)已知:
B2(g)+
B2(g)+
试写出BA3与C2反应生成BC2和A
(4)3 mol A的单质与1 mol B的单质在一个体积恒定的密闭容器中反应,生成化合物M,达到平衡时,M的体积分数为m。若将a mol A的单质、b mol B的单质、c mol M同时置于上述容器中,在相同温度下反应,达到平衡时,M的体积分数仍为m,则a、b、c必须满足的关系是____________________________________________________。
A、B、C、D、E、F六种物质中除D为单质外,其余均是常见的化合物,E和F的水溶液均呈碱性,它们的转化关系如下图所示。请回答下列问题:
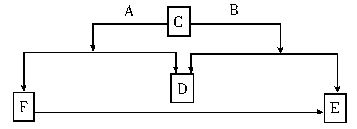
(1)写出A、B、D的化学式:A_______,B_______,D________。
(2)E和F可相互转化,图中已标明F向E转化的关系,请写出E转化为F的化学方程式:_____________。
A、B、C、D、E、F、G七种元素的原子序数依次递增。已知:
①G的原子序数为29,其余的均为短周期主族元素;
②A是宇宙中含量最多的元素,B原子最外层电子数是次外层电子数的2倍,C原子核外有三个未成对电子;
③D和E原子价电子排布式均为ns2np4;④F的单质是黄绿色气体。
请回答下列问题:
(1)G2+的核外电子排布式是 。在[G(NH3)4]2+离子中,G2+与NH3分子形成的是 键。
(2)与B、C形成的阴离子(BC—)互为等电子体的微粒有 、 (分子和离子各写一种)。
(3)B与C形成的化合物中,下列判断正确的是 。
a.氢化物稳定性:B>C b.氢化物沸点:B<C
c.最高价氧化物的水化物酸性:B<C d.非金属性:B>C
(4)B、C、D第一电离能由小到大的顺序为 (用元素符号作答),B的一种氢化物相对分子质量为26,分子中的σ键与π键数目比为 。
(5)七种元素中,电负性最大的元素与B元素形成化合物电子式为 ,该物质的晶体属于 。
(10分)A、B、C、D、E、F、G七种元素的原子序数依次递增。已知:
①G的原子序数为29,其余的均为短周期主族元素;
②A是宇宙中含量最多的元素,B原子最外层电子数是次外层电子数的2倍,C原子核外有三个未成对电子;
③D和E原子价电子排布式均为ns2np4;④F的单质是黄绿色气体。
请回答下列问题:
(1)G2+的核外电子排布式是 。在[G(NH3)4]2+离子中,G2+与NH3分子形成的是 键。
(2)与B、C形成的阴离子(BC—)互为等电子体的微粒有 、 (分子和离子各写一种)。
(3)B与C形成的化合物中,下列判断正确的是 。
a.氢化物稳定性:B>C b.氢化物沸点:B<C
c.最高价氧化物的水化物酸性:B<C d.非金属性:B>C
(4)B、C、D第一电离能由小到大的顺序为 (用元素符号作答),B的一种氢化物相对分子质量为26,分子中的σ键与π键数目比为 。
(5)七种元素中,电负性最大的元素与B元素形成化合物电子式为 ,该物质的晶体属于 。
已知A、B、C、D、E为中学化学常见的五种物质,均含元素Y,有的还可能含有元素X、Z,元素X、Y、Z的原子序数依次递增。常温下,A、B、C、D为气体。
①元素Y在A、B、C、D、E中所呈化合价依次递增,其中只有B为单质。
②D+H2O→C+E
请回答下列问题:
(1)元素Y在元素周期表中的位置为______________;A分子的空间构型是_______;B分子的电子式为___________。
(2)由B气体反应生成1mol A气体时放出的热量为46.2kJ,写出该反应的热化学方程式_____________________________________________________。
(3)D的相对分子质量的理论值总是小于实验测定值的原因是_______________。
(4)工业上,若输送Cl2的管道漏气,用A进行检验时可观察到大量白烟,同时有B生成。写出该反应的化学方程式___________________________________。在相同条件下,若反应物无剩余,则反应前气体对反应后气体的相对密度为__________(保留到小数点后两位)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com