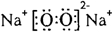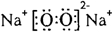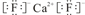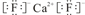有A、B、C、D、E、F六种元素,已知:
①它们位于三个不同短周期,核电荷数依次增大.
②E元素的电离能数据见下表(kJ?mol
-1):
| I1 |
I2 |
I3 |
I4 |
… |
| 496 |
4562 |
6912 |
9540 |
… |
③B与F分别同主族.
④A、E分别都能与D按原子个数比1﹕1或2﹕l形成化合物.
⑤B、C分别都能与D按原子个数比1﹕1或1﹕2形成化合物.
(1)写出只含有A、B、D、E四种元素的盐的化学式
NaHCO3
NaHCO3
;
(2)B
2A
2分子中存在
3
3
个σ键,
2
2
个π键;
(3)下表列出了上述部分元素形成的化学键的键能:
| 化学键 |
F-D |
F-F |
B-B |
F-B |
C═D |
D═D |
| 键能/kJ?mol-1 |
460 |
176 |
347.7 |
347 |
745 |
497.3 |
①下列四种物质形成的晶体,熔点由高到低的顺序(用a、b、c、d表示):
a>c>d>b
a>c>d>b
.
a.F与D形成的化合物 b.B与D形成的稳定化合物 c.F的单质 d.E与D形成的化合物
②试写出1molF单质晶体和氧气反应的热化学方程式
Si(s)+O2(g)=SiO2(s)△H=-989.2kJ/mol
Si(s)+O2(g)=SiO2(s)△H=-989.2kJ/mol
.



 有A、B、C、D、E、F六种元素,已知:它们位于三个不同短周期,核电荷数依次增大;A与E、B与F分别同主族;A、E分别都能与D按原子个数比1﹕1或2﹕l形成化合物;B、C分别都能与D按原子个数比1﹕1或1﹕2形成化合物.
有A、B、C、D、E、F六种元素,已知:它们位于三个不同短周期,核电荷数依次增大;A与E、B与F分别同主族;A、E分别都能与D按原子个数比1﹕1或2﹕l形成化合物;B、C分别都能与D按原子个数比1﹕1或1﹕2形成化合物.