
题目列表(包括答案和解析)
(1)他能否制得较纯净的Na2CO3? 。理由: 。?

图7-7
(2)按他的设计,第①步实验装置如图7-7。?
①装置A使用的试剂是石灰石和盐酸溶液,可否使用纯碱代替石灰石? ,原因是 。?
②装置B使用的试剂是 ,作用是 。?
③为了便于后续实验的煮沸、混合等操作,装NaOH溶液的容器还可使用 (填仪器名称)。?
(3)有人认为将实验步骤②③的顺序对调,即先混合,再煮沸会更合理,你认为对吗? (填“合理”或“不合理”),为什么? 。
化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)常温下,取pH=2的盐酸和醋酸溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是________(填“A”或“B”)。设盐酸中参加反应的Zn粒质量为m1,醋酸溶液中参加反应的Zn粒质量为m2,则m1________m2(选填“<”、“=”或“>”)。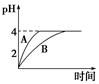
(2)已知常温下Cu(OH)2的Ksp=2×10-20。又知常温下某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于________;要使0.2 mol·L-1的CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加NaOH溶液,使溶液pH为________。
(3)10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度/℃ | 10 | 20 | 30 | 加热煮沸后冷却到50 ℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
| 温度/℃ | 10 | 20 | 30 | 加热煮沸后冷却至 50℃ | pH | 8.3 | 8.4 | 8.5 | 8.8 |
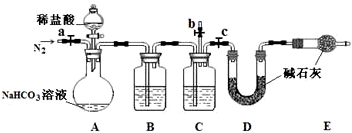
用50 mL NaOH溶液吸收CO2气体制备Na2CO3,为防止通入的CO2过量而生成NaHCO3?,他设计了如下步骤:①用25 mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;②小心煮沸溶液1—2 min;③在得到的溶液中加入另一半(25 mL) NaOH溶液,使溶液充分混合。
(1)他能否制得较纯净的Na2CO3?__________,理由是_____________________________。
(2)按他的设计,第①步实验装置如图15-7所示:

图15-7
a.装置A使用的试剂是石灰石和盐酸溶液,可否使用纯碱代替石灰石?____________,原因是__________________________________________________________。
b.装置B使用的试剂是_____________,作用是_____________________________________。
c.为了后续的加热煮沸、混合等实验,盛NaOH溶液的容器还可使用__________(填实验仪器)。
d.有人认为将实验步骤②③的顺序对调,即先混合,再煮沸,这样操作更合理,你认为对吗?_________;为什么?___________________________________________________。
碳酸钠俗称纯碱,其用途很广。实验室中,用碳酸氢铵和饱和食盐水可制得纯碱。各物质在不同温度下的溶解度见表。
|
溶解度 溶质 g/100g水 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
|
NaCl |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
37.8 |
|
NH4HCO3 |
15.8 |
21.0 |
27.0 |
|
|
|
|
|
NaHCO3 |
8.2 |
9.6 |
11.1 |
12.7 |
14.4 |
16.4 |
|
|
NH4Cl |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
55.2 |
60.2 |
实验步骤
Ⅰ、化盐与精制:①粗盐(含Ca2+、Mg2+、SO42-)溶解;②加入足量NaOH和Na2CO3溶液,煮沸;③过滤;④加入盐酸调pH至7。
Ⅱ、转化:①将精制后的食盐溶液温度控制在30~35℃之间;在不断搅拌下,加入研细的碳酸氢铵;保温,搅拌半小时;②静置, a 、 b ;③得到NaHCO3晶体。
Ⅲ、制纯碱:将得的NaHCO3放入蒸发皿中,在酒精灯上灼烧,冷却到室温,即得到纯碱。
完成下列填空:
(1)“化盐与精制”可除去的粗盐中的杂质离子是 。
(2)“转化”的离子方程式是 。
(3)“转化”过程中,温度控制在30~35℃之间的加热方式是 ;为什么温度控制在30~35℃之间? 。
(4)a、b处的操作分别是 、 。
(5)实验室制得的纯碱含少量NaCl还可能含少量NaHCO3,为测定纯碱的纯度,用电子天平准确称取样品G克,将其放入锥形瓶中用适量蒸馏水溶解,滴加2滴酚酞,用c mol/L的标准盐酸滴定至溶液由浅红色变成无色且半分钟不变,滴定过程中无气体产生,所用盐酸的体积为V1 mL。此时发生的反应为:CO32- + H+ →HCO3-
①样品中碳酸钠质量百分含量的表达式是 。
②向锥形瓶溶液中继续滴加2滴甲基橙,用同浓度的盐酸继续滴定至终点,所用盐酸的体积为V2mL。滴定终点时溶液颜色的变化是 ;根据实验数据,如何判断样品含有NaHCO3 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com