
题目列表(包括答案和解析)
(12分)下列三个反应在某密闭容器中进行:
反应① Fe(s)+CO2(g) FeO(s)+CO(g) △H1=" a" kJ·mol-1
FeO(s)+CO(g) △H1=" a" kJ·mol-1
反应② 2CO(g)+O2(g) 2CO2(g) △H2=" b" kJ·mol-1
2CO2(g) △H2=" b" kJ·mol-1
反应③ 2Fe(s)+O2(g) 2FeO(s) △H3
2FeO(s) △H3
(1)则△H3= (用含a、b的代数式表示)
(2)已知500℃时反应①的平衡常数K=1.0,在此温度下2L密闭容器中进行反应①,Fe和CO2的起始量均为2.0mol,达到平衡时CO2的转化率为
(3)将上述平衡体系升温至700℃,再次达到平衡时体系中CO的浓度是CO2浓度的两倍,则
a 0(填“>”、“<”或“=”)。为了加快化学反应速率且使体系中CO的物质的量增加,其它条件不变时,可以采取的措施有 (填序号)。
| A.缩小反应器体积 | B.再通入CO2 |
| C.升高温度 | D.使用合适的催化剂 |
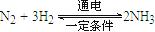 。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。
。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。(12分)下列三个反应在某密闭容器中进行:
反应①
Fe(s)+CO2(g) FeO(s)+CO(g) △H1="
a" kJ·mol-1
FeO(s)+CO(g) △H1="
a" kJ·mol-1
反应②
2CO(g)+O2(g) 2CO2(g) △H2=" b"
kJ·mol-1
2CO2(g) △H2=" b"
kJ·mol-1
反应③
2Fe(s)+O2(g) 2FeO(s) △H3
2FeO(s) △H3
(1)则△H3= (用含a、b的代数式表示)
(2)已知500℃时反应①的平衡常数K=1.0,在此温度下2L密闭容器中进行反应①,Fe和CO2的起始量均为2.0mol,达到平衡时CO2的转化率为
(3)将上述平衡体系升温至700℃,再次达到平衡时体系中CO的浓度是CO2浓度的两倍,则
a 0(填“>”、“<”或“=”)。为了加快化学反应速率且使体系中CO的物质的量增加,其它条件不变时,可以采取的措施有 (填序号)。
A.缩小反应器体积 B.再通入CO2
C.升高温度 D.使用合适的催化剂
(4)最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实现氮的固定——氨的电解法合成,大大提高了氮气和氢气的转化率。总反应式为: 。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。
。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。
(5)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显___________性(填“酸”“碱”或“中”), 可推断a 0.01(填大于、等于或小于)。
(8分)在体积为2 L的密闭容器中,充入lmol CO2和2.6mol H2,一定条件下发生反应:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H= ―49.0 kJ?mol-1
CH3OH(g)+H2O(g) △H= ―49.0 kJ?mol-1
测得CO2和CH3OH(g)的浓度随时间变化如右图所示:
(1)从反应开始到第10 min,氢气的平均反应速率v(H2)= ,在这段时间内,反应放出的热量= 。
(2)在该条件下,反应的平衡常数K的值 = ,如果在某一时刻保持温度不变,只改变浓度,使c(CO2) =1.00 mol/L,c(H2) = 2.00 mol/L,c(CH3OH) = c(H2O) = 0.80 mol/L,则平衡 (填写序号)。
a.向正反应方向移动 b.向逆反应方向移动 c.不移动 d.无法确定平衡移动方向
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是 (填写序号)。
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离 d.再充入l mol CH3OH(g)
(4)在催化剂的作用下,CO2与H2能够合成许多物质,如甲醇、烃类、二甲醚等,但反应体系中若混入杂质,则反应很难进行,可能的原因是 。
在体积为l L的密闭容器中,充入lmol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) + 49.0 kJ
CH3OH(g)+H2O(g) + 49.0 kJ
测得CO2和CH3OH(g)的浓度随时间变化如图所示:
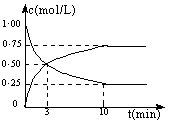
(1)从反应开始到第10 min,氢气的平均反应速率v(H2)= ,在这段时间内,反应放出的热量=
(2)在该条件下,反应的平衡常数K的值 = (保留2位小数),如果在某一时刻保持温度不变,只改变浓度,使c(CO2) =1.00 mol/L,c(H2) = 0.40 mol/L,c(CH3OH) = c(H2O) = 0.80 mol/L,则平衡 (填写序号)。
a.向正反应方向移动 b.向逆反应方向移动
c.不移动 d.无法确定平衡移动方向
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是 (填写序号)。
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离 d.再充入l mol CH3OH(g)
(4)在催化剂的作用下,CO2与H2能够合成许多物质,如甲醇.烃类.二甲醚等,但反应体系中混入杂质,则反应很难进行,可能的原因是 。
I.已知:反应①H2(g) + Cl2(g) = 2HCl(g) ΔH= —184 kJ/mol
②4HCl(g)+O2(g)
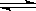 2Cl2(g)+2H2O(g)
ΔH= —115.6 kJ/mol
2Cl2(g)+2H2O(g)
ΔH= —115.6 kJ/mol


请回答:
(1)H2与O2反应生成气态水的热化学方程式
(2)断开1 mol H—O 键所需能量约为 kJ。
II.实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为:  ,它所对应的化学方程式为:
。
,它所对应的化学方程式为:
。
(2)已知在400℃时,N2 (g)+ 3H2(g) 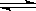 2NH3(g)
△H<0 的K=0.5, 则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)。欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的正确措施是 (填序号)
2NH3(g)
△H<0 的K=0.5, 则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)。欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的正确措施是 (填序号)
A.缩小体积增大压强 B.升高温度 C.加催化剂 D.使氨气液化移走
(3)在一定体积的密闭容器中,进行如下化学反应:A(g) + 3B(g) 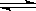 2C(g) + D(s) ΔH,其化学平衡常数K与温度t的关系如下表:
2C(g) + D(s) ΔH,其化学平衡常数K与温度t的关系如下表:
|
t/K |
300 |
400 |
500 |
… |
|
K/(mol·L-1)2 |
4×106 |
8×107 |
K1 |
… |
请完成下列问题:
①判断该反应的ΔH 0(填“>”或“<”)
②在一定条件下,能判断该反应一定达化学平衡状态的是 (填序号)。
A.3v(B)(正)=2v(C)(逆) B.A和B的转化率相等
C.容器内压强保持不变 D.混合气体的密度保持不变
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com