
题目列表(包括答案和解析)
有E、Q、T、X、Z五种前四周期元素,原子序数E<Q<T<X<Z。E、Q、T三种元素的基态原子具有相同的能层和能级,且I1(E)<I1(T)<I1(Q),其中基态Q原子的2p轨道处于半充满状态,且QT2+与ET2互为等电子体。x为周期表前四周期中电负性最小的元素,Z的原子序数为28。请回答下列问题(答题时如需表示具体元素,请用相应的元素符号):
(1)写出QT2+的电子式 ,基态Z原子的核外电子排布式为 。
(2)Q的简单氢化物极易溶于T的简单氢化物,其主要原因有 (写两条)。
(3)ET2的空间构型为 ,为 分子(填“极性”或“非极性”)
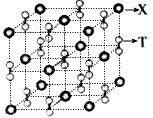
(4)化合物甲由T、X两元素组成,高温下,化合物甲晶体呈立方体结构,其晶胞如图,甲的化学式为 。晶体中氧的化合价部分为0价,部分为-2价,则下列说法正确的是 ( )

A.每个晶胞中含有14个心和13个O2-
B.晶体中每个K+周围有8个O2-,每O2-周围有8个K+
C.晶体中与每个K距离最近的K+有8个
D.晶体中,O价氧原子与-2价氧原子的数目比为3:l
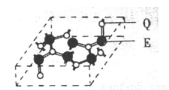
(5)化合物乙的晶胞如图,乙由E、Q两元素组成,硬度超过金刚石。则乙的晶体中E、Q两种元素原子的杂化方式均为 。
| 有E、Q、T、X、Z五种前四周期元素,原子序数E<Q<T<X<Z。E、Q、T三种元素的基态原子具有相同的能层和能级,且I1(E)<I1(T)<I1(Q),其中基态Q原子的2p轨道处于半充满状态,且QT2+与ET2互为等电子体。X为周期表前四周期中电负性最小的元素,Z的原子序数为28。请回答下列问题(答题时如需表示具体元素,请用相应的元素符号) (1)写出QT2+的电子式___________,基态Z原子的核外电子排布式为___________。 (2)Q的简单氢化物极易溶于T的简单氢化物,其主要原因有______________________(写两条)。 (3)ET2的空间构型为___________,为___________分子(填“极性”或“非极性”) (4)化合物甲由T、X两元素组成,高温下,化合物甲晶体呈立方体结构,其晶胞如图,甲的化学式为 ____________。晶体中氧的化合价部分为0价,部分为-2价,则下列说法正确的是____________ |
 |
| A.每个晶胞中含有14个心和13个O2- B.晶体中每个K+周围有8个O2-,每O2-周围有8个K+ C.晶体中与每个K距离最近的K+有8个 D.晶体中,O价氧原子与-2价氧原子的数目比为3:l (5)化合物乙的晶胞如图,乙由E、Q两元素组成,硬度超过金刚石。则乙的晶体中E、Q两种元素原子的杂化方式均为_________________。 |
 |
有E、Q、T、X、Z五种前四周期元素,原子序数E<Q<T<X<Z。E、Q、T三种元素的基态原子具有相同的能层和能级,且I1(E)<I1(T)<I1(Q),其中基态Q原子的2p轨道处于半充满状态,且QT2+与ET2互为等电子体。x为周期表前四周期中电负性最小的元素,Z的原子序数为28。请回答下列问题(答题时如需表示具体元素,请用相应的元素符号):
(1)写出QT2+的电子式 ,基态Z原子的核外电子排布式为 。
(2)Q的简单氢化物极易溶于T的简单氢化物,其主要原因有 (写两条)。
(3)ET2的空间构型为 ,为 分子(填“极性”或“非极性”)
(4)化合物甲由T、X两元素组成,高温下,化合物甲晶体呈立方体结构,其晶胞如图,甲的化学式为 。晶体中氧的化合价部分为0价,部分为-2价,则下列说法正确的是 ( )
A.每个晶胞中含有14个心和13个O2-
B.晶体中每个K+周围有8个O2-,每O2-周围有8个K+
C.晶体中与每个K距离最近的K+有8个
D.晶体中,O价氧原子与-2价氧原子的数目比为3:l
(5)化合物乙的晶胞如图,乙由E、Q两元素组成,硬度超过金刚石。则乙的晶体中E、Q两种元素原子的杂化方式均为 。
A、B、C、D、E、F、G是前四周期的七种元素,其原子序数依次增大.A的基态原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同;D及其同主族元素的氢化物沸点变化趋势如图;F是地壳中含量最高的金属元素;E与F同周期,E的第一电离能高于F;G与F同主族.请回答下列问题:

(1)写出G元素基态原子的核外电子排布式________;
(2)B、C、D三种元素第一电离能由大到小的顺序是________(用元素符号表示);
(3)下列有关上述元素的说法,正确的是________(填序号);
①CA3沸点高于BA4,主要是因为前者相对分子质量较大
②配合物Ni(BD)4常温下为液态,易溶于CCl4、苯等有机溶剂,因此固态Ni(BD)4属于分子晶体
③C的氢化物的中心原子采取sp2杂化
④F单质的熔点高于E单质,是因为F单质的金属键较强
⑤比G的原子序数少1的元素第一电离能高于G
(4)CA3分子的空间构型为________,14 g B2A4分子中含有________molσ键;
(5)ED是优良的耐高温材料,其晶体结构与NaCl晶体相似.ED的熔点比NaCl高,其原因是________.
X、Y、Z、U为原子序数依次增大的前四周期元素,X、Y、Z三种元素位于同一周期,其中基态Y原子的2p轨道处于半充满状态,Y和Z的单质可以通过分离液态空气的方法大量制得,且XZ2与Y2Z互为等电子体。含U的化合物的焰色为紫色。试回答下列问题:
(1)U单质的原子堆积方式为__________________,Y的价电子排布式为__________________。
(2)化合物甲由Z、U两元素组成,其晶胞如图所示。
①甲的化学式为____________。
②下列有关该晶体的说法中正确的是________(选填选项字母)。
A.每个晶胞中含有14个U+ 和13个Z2-
B.晶体中每个U+ 周围距离最近的U+ 有6个
C.该晶体属于离子晶体
③甲的密度为a g·cm-3,则晶胞的体积是_____________ m3(只要求列出计算式,阿伏加德罗常数的值用NA表示)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com