
题目列表(包括答案和解析)
下表为周期表的一部分,其中的编号代表对应的元素。
试填空。
(1)写出上表中元素I的基态原子的电子排布式和价层电子排布图: 。
元素C、D、E、F的第一电离能由大到小的顺序是 (用元素符号表示)。
(2)元素A分别与C、D、E形成最简单的常见化合物分子甲、乙和丙。下列有关叙述不正确的有 。
A.甲、乙和丙分子的空间构型分别为正四面体形、三角锥形、V形
B.甲、乙和丙分子中,中心原子均采取sp3的杂化方式
C.三种分子中键角由大到小的顺序是丙>乙>甲
D.甲、乙和丙分子均为由极性键构成的极性分子
(3)由元素J、C、E组成一种化学式为J(CE)5的配位化合物,该物质常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂。据此可判断:
①该化合物的晶体类型为 。
②该化合物的晶体中存在的作用力有 。
A.离子键
B.极性键
C.非极性键
D.范德华力
E.氢键
F.配位键
③根据共价键理论和等电子体理论分析,CE分子中σ键与π键的数目比为 。
(4)在测定A与F形成的化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是 。
(5)某些不同族元素的性质也有一定的相似性,如表中元素G与元素B,原因是 。
能源是制约国家发展进程的因素之一。甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚。
(1)工业上,可以分离合成气中的氢气,用于合成氨,常用醋酸二氨合亚铜
[Cu(NH3)2Ac]溶液(Ac=CH3COO-)(来吸收合成气中的一氧化碳,其反虚原理为:
[Cu(NH3)2Ac](aq)+CO+NH3 [Cu(NH3)3]Ac•CO(aq)(△H<0)
[Cu(NH3)3]Ac•CO(aq)(△H<0)
常压下,将吸收一氧化碳的溶液处理重新获得[Cu(NH3)2]AC溶液的措施是 ;
(2)工业上一般采用下列两种反应合成甲醇:
反应a:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
反应b:CO(g)+2H2(g) CH3OH(g) △H<0
CH3OH(g) △H<0
①对于反应a,某温度下,将4.0 mol CO2(g)和12.0 mol H2(g)充入容积为2L的密闭容器中,反应到达平衡时,测得甲醇蒸气的体积分数为30%,则该温度下反应的平衡常数为 ;
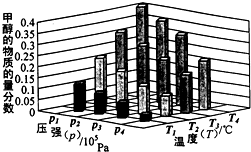
②对于反应b,某温度下,将1.0mol CO(g)和2.0 mol H2(曲充入固定容积的密闭容器中,反应到达平衡时,改变温度和压强,平衡体系中CH3OH的物质的量分数变化情况如图所示,温度和压强的关系判断正确的是 ;(填字母代号)

A.p3>p2,T3>T2
B.p2>p4,T4>T2
C.p1>p3,T1>T3
D.p1>p4,T2>T3
(3)CO可以合成二甲醚,二甲醚可以作为燃料电池的原料,化学反应原理为:
CO(g)+4H2(g) CH3OCH3(g)+H2O(g) △H<0
CH3OCH3(g)+H2O(g) △H<0
①在恒容密闭容器里按体积比为1:4充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是 ;
A.逆反应速率先增大后减小
B.正反应速率先增大后减小
C.反应物的体积百分含量减小
D.化学平衡常数K值增大
②写出二甲醚碱性燃料电池的负极电极反应式 ;
③己知参与电极反应的电极材料单位质量放出电能的大小称为该电池的比能量。关于二甲醚碱性燃料电池与乙醇碱性燃料电池,下列说法正确的是 (填字母)
A.两种燃料互为同分异构体,分子式和摩尔质量相同,比能量相同
B.两种燃料所含共价键数目相同,断键时所需能量相同,比能量相同
C.两种燃料所含共价键类型不同,断键时所需能量不同,比能量不同
(4)已知l g二甲醚气体完全燃烧生成稳定的氧化物放出的热量为31.63 kJ,请写出表示二甲醚燃烧热的热化学方程式 。
能源是制约国家发展进程的因素之一。甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚。
(1)工业上,可以分离合成气中的氢气,用于合成氨,常用醋酸二氨合亚铜
[Cu(NH3)2Ac]溶液(Ac=CH3COO-)(来吸收合成气中的一氧化碳,其反虚原理为:
[Cu(NH3)2Ac](aq)+CO+NH3 [Cu(NH3)3]Ac?CO(aq)(△H<0)
[Cu(NH3)3]Ac?CO(aq)(△H<0)
常压下,将吸收一氧化碳的溶液处理重新获得[Cu(NH3)2]AC溶液的措施是 ;
(2)工业上一般采用下列两种反应合成甲醇:
反应a:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
反应b:CO(g)+2H2(g) CH3OH(g) △H<0
CH3OH(g) △H<0
①对于反应a,某温度下,将4.0 mol CO2(g)和12.0 mol H2(g)充入容积为2L的密闭容器中,反应到达平衡时,测得甲醇蒸气的体积分数为30%,则该温度下反应的平衡常数为 ;
②对于反应b,某温度下,将1.0mol CO(g)和2.0 mol H2(曲充入固定容积的密闭容器中,反应到达平衡时,改变温度和压强,平衡体系中CH3OH的物质的量分数变化情况如图所示,温度和压强的关系判断正确的是 ;(填字母代号)
A.p3>p2,T3>T2
B.p2>p4,T4>T2
C.p1>p3,T1>T3
D.p1>p4,T2>T3
(3)CO可以合成二甲醚,二甲醚可以作为燃料电池的原料,化学反应原理为:
CO(g)+4H2(g) CH3OCH3(g)+H2O(g) △H<0
CH3OCH3(g)+H2O(g) △H<0
①在恒容密闭容器里按体积比为1:4充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是 ;
A.逆反应速率先增大后减小
B.正反应速率先增大后减小
C.反应物的体积百分含量减小
D.化学平衡常数K值增大
②写出二甲醚碱性燃料电池的负极电极反应式 ;
③己知参与电极反应的电极材料单位质量放出电能的大小称为该电池的比能量。关于二甲醚碱性燃料电池与乙醇碱性燃料电池,下列说法正确的是 (填字母)
A.两种燃料互为同分异构体,分子式和摩尔质量相同,比能量相同
B.两种燃料所含共价键数目相同,断键时所需能量相同,比能量相同
C.两种燃料所含共价键类型不同,断键时所需能量不同,比能量不同
(4)已知l g二甲醚气体完全燃烧生成稳定的氧化物放出的热量为31.63 kJ,请写出表示二甲醚燃烧热的热化学方程式 。
 能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.
能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.下表为周期表的一部分,其中的编号代表对应的元素。
试填空。
(1)写出上表中元素I的基态原子的电子排布式和价层电子排布图:________________________________________________________________________。
元素C、D、E、F的第一电离能由大到小的顺序是________(用元素符号表示)。
(2)元素A分别与C、D、E形成最简单的常见化合物分子甲、乙和丙。下列有关叙述不正确的有________。
A.甲、乙和丙分子的空间构型分别为正四面体形、三角锥形、V形
B.甲、乙和丙分子中,中心原子均采取sp3的杂化方式
C.三种分子中键角由大到小的顺序是丙>乙>甲
D.甲、乙和丙分子均为由极性键构成的极性分子
(3)由元素J、C、E组成一种化学式为J(CE)5的配位化合物,该物质常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂。据此可判断:
①该化合物的晶体类型为________。
②该化合物的晶体中存在的作用力有________。
A.离子键 B.极性键
C.非极性键 D.范德华力
E.氢键 F.配位键
③根据共价键理论和等电子体理论分析,CE分子中σ键与π键的数目比为________。
(4)在测定A与F形成的化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是________________________________________________。
(5)某些不同族元素的性质也有一定的相似性,如表中元素G与元素B,原因是_____________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com