
题目列表(包括答案和解析)
已知A、B、C、D、E、F、G七种物质有如下转化关系。A、B、C、E都是由两种元素组成的化合物,D、F、G在常温下分别是固态、液态、气态单质,D、F的组成元素在周期表中位于同一主族。E溶液为浅绿色,与NaOH溶液反应生成的白色沉淀极易被氧化。
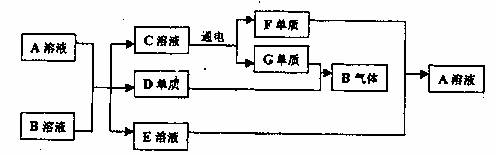
试回答下列问题:
(1)写出A与B反应的化学方程式 。
(2)写出E溶液与F单质反应的离子方程式 。
(3)检验A中阳离子最常用的试剂可用一种钾盐,其化学式为 。
(4)实验室制得的B所体,不能用浓硫酸作干燥剂,其原因是 。
(5)用惰性电极电解C溶液,其阳极反应为 ,当转移1mole时在阴极可收集到气体的体积为 L(标准状况下)
(6)将2mol 气体B放入某固定容积的密闭容器中,在一定温度下反应达到平衡,测得D蒸气的体积分数为40%。若其它条件不就,再向该容器中充入2mol气体B,当体系的颜色不再变化时D蒸气的体积分数 (填“大于”、“小于”、“等于”)40%。
下表是元素周期表的一部分.
(1)表中元素⑩的氢化物的化学式为 ,此氢化物的还原性比元素⑨的氢化物的还原性 (填强或弱)
(2)某元素原子的核外电子层中L层电子数比K层电子数多3,则该元素的元素符号是 ,其单质的电子式为 .
(3)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。写出元素③的氢氧化物与NaOH溶液反应的化学方程式:
;
又如表中与元素⑦的性质相似的不同族元素是 (填元素符号)
(4)元素⑤的氢化物是最重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国人哈伯在1905年发明的,其合成原理为:N2(g)+3H2(g)![]() 2NH3(g) △H= -92.4kJ/mol,他因此获得了1918年诺贝尔化学奖。试回答下列问题:
2NH3(g) △H= -92.4kJ/mol,他因此获得了1918年诺贝尔化学奖。试回答下列问题:
①合成氨工业中采取的下列措施可用勒夏特列原理解释的是 (填序号)
A.采用较高压强(20Mpa~50Mpa)
B.采用500℃的高温
C.用铁触媒作催化剂
D.将生成的氨液化并及时从体系中分离出来,N2和H2循环到合成塔中并补充N2和H2
②上图是实验室模拟工业法合成氨的简易装置。简述检验有氨气生成的方法 。
③在298K时,将10 mol N2和30 mol H2放入合成塔中,为何放出的热量小于924kJ?
。
④1998年希腊亚里斯多德大学的Marmellos和Stoukides发明一种合成氨的新方法。在常压下,将H2与用He稀释的N2分别通入一加热到570℃的,以锶-铈-钇-钙钛矿多孔陶瓷(SCY)为固体电解质的电解池中转化为氨气(SCY陶瓷能传递H+),H2转化率达到78%。其实验装置如图所示。阴极的电极反应式 。
(10分)下表是元素周期表的一部分,表中字母分别代表某一化学元素,请回答有关问题。
(1)人们曾认为g、h、i不发生化学反应,因而把它们叫做稀有气体,但是后来发现这族气体可以参加化学反应,你认为g、h、i中最有可能首先被发现可以参加化学反应的元素是_______(写元素符号);g、h、i第一电离能由大到小的顺序为______。(用元素符号表示)
(2)e元素原子结构示意图为_____ __。d元素原子核外电子排布式为_____ __。
(3)a的阴离子半径__ __b的阳离子半径(填大于、等于、小于)。
(4)在元素周期表中有一个对角线规则,其中包括b、c的化合物的性质十分相似。则b的氯化物分别与少量和过量的氢氧化钠溶液发生反应的离子方程式分别为(要表达出具体的元素符号,下同)______ _______ __________;___________ ________________。
(5)f的+4价氧化物可与浓盐酸反应,且已知其氧化性强于氯气,则该氧化物与浓盐酸反应的化学方程式可表示为_____________ _________________________。
(6)元素周期表中第6周期中的镧系元素共有 种,它们原子的电子层结构和性质十分相似。
(7)元素k的氢化物乙可由两种10个电子的微粒组成的化合物甲(化学式X3Y2)与水剧烈反应能生成。甲与水反应的化学反应方程式为:____ ___。
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
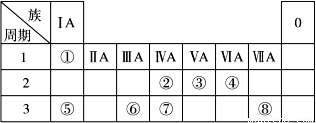
(1)地壳中含量居于第二位的元素在周期表中的位置是________________。
(2)②的最高价氧化物固态时的晶体类型:______________;⑦的最高价氧化物固态时的晶体类型:______________。
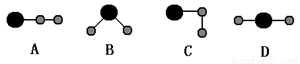
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式______________,______________。若用球棍模型表示①和④形成的化合物的分子结构,应该是_____________。
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是( )
A.最高正化合价为+6价, B.气态氢化物比H2S稳定,
C.最高价氧化物的水化物的酸性比硫酸弱, D.单质在常温下可与氢气化合。
(5) 已知X为ⅡA族元素(第一到第七周期),其原子序数为a,Y与X位于同一周期,且为ⅢA族元素,则Y的原子序数b与a所有可能的关系式___________________________。
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
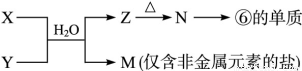
X溶液与Y溶液反应的离子方程式________, M中阳离子的鉴定方法____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com