
题目列表(包括答案和解析)

| 时间 \CO转化率 \温度 |
1小时 | 2小时 | 3小时 | 4小时 |
| T1 | 30% | 50% | 80% | 80% |
| T2 | 35% | 60% | a1 | a2 |
研究碳及其化合物的性质对促进低碳社会的构建具有重要意义。
(1)将不同量的CO(g)和H2O(g)分别通人体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)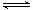 CO2(g)+H2(g),得到如下两组数据:
CO2(g)+H2(g),得到如下两组数据:
|
实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
|
CO |
H2O |
H2 |
CO |
|||
|
1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
|
2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
①实验1中以CO2表示的反应速率为_____________(保留2位小数);
②该反应为___________(填“吸热”或“放热”)反应;
③实验2的平衡常数为___________________________。
(2)已知在常温常压下:
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1451.6kJ/mol
2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ/mol
写出甲醇不完全燃烧生成CO和液态水的热化学方程式_______________________________。
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,实验室用如图装置模拟该过程,其原理是:通电后,Co2+被氧化成Co3+,然后以Co3+做氧化剂把甲醇氧化成CO2而除去(Co3+的还原产物是CO2+)。
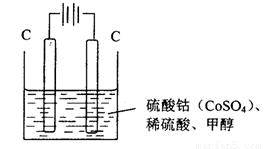
①写出阳极电极反应式_______________________________________________________________ ;
②写出除去甲醇的离子方程式__________________________________________________________。
研究氮及其化合物具有重要意义。请回答下列问题:
(1)脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3(g) +NO(g) +NO2(g) 2N2(g)
+3H2O(g) △H<0,反应的氧化剂是________________。
2N2(g)
+3H2O(g) △H<0,反应的氧化剂是________________。
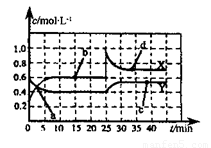
(2)巳知NO2和N2O4可以相互转化:2NO2(g) N2O4(g) △H<0,现将一定量的混合气体通入一恒温密闭容器中反应,浓度随时间变化关系如图所示。则图中两条曲线X和Y,表示N2O4浓度变化的是____,b、c、d三点的化学反应速率大小关系是______;25min时,曲线发生图中变化,可采取的措施是_________。
N2O4(g) △H<0,现将一定量的混合气体通入一恒温密闭容器中反应,浓度随时间变化关系如图所示。则图中两条曲线X和Y,表示N2O4浓度变化的是____,b、c、d三点的化学反应速率大小关系是______;25min时,曲线发生图中变化,可采取的措施是_________。
(3)25℃时,将NH3溶于水得100 mL0.1 mol • L-1的氨水,测得pH=11,则该条件下,NH3 • H2O的电离平衡常数Kb=_______。
(4)已知:N2(g)+O2(g)=2NO(g) △H=+180kJ/mol;
2NO(g)+O2(g)=2NO2(g) △H=-112kJ/mol;
2C(s)+O2(g)=2CO(g) △H=-221kJ/mol;
C(s)+O2(g)=CO2 (g) △H=-393.5kJ/mol。
则反应4CO(g)+2NO2(g)=4CO2 (g)+ N2(g) △H=________。
(5)用电化学法可获得N2O5。如图装置中,阳极的电极反应式为:N2O4+2HNO3-2e-=2N2O5+2H+,则该电解反应的化学方程式为________________。

研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g);ΔH1=+489.0 kJ·mol-1
C(s)+CO2(g)=2CO(g);ΔH2=+172.5 kJ·mol-1。
则CO还原Fe2O3的热化学方程式为________________________________
(2)某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CH3OH的物质的量随时间的变化如图所示,请回答下列问题:
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CH3OH的物质的量随时间的变化如图所示,请回答下列问题: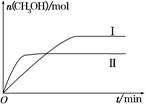
①该反应的平衡常数的表达式为K=________。
②曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ________KⅡ(填“大于”、“等于”或“小于”)。
③在下图a、b、c三点中,H2的转化率由高到低的顺序是________(填字母)。
(3)在其他条件不变的情况下,将容器体积压缩到原来的1/2,与原平衡相比,下列有关说法正确的是________(填序号)。
a.氢气的浓度减小
b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加
d.重新平衡时n(H2)/n(CH3OH)增大
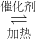 7N2(g)+12H2O(g)也可处理NO2.则化学平衡常数表达式K=______;当转移1.2mol电子时,消耗的NO2在标准状况下是______L.
7N2(g)+12H2O(g)也可处理NO2.则化学平衡常数表达式K=______;当转移1.2mol电子时,消耗的NO2在标准状况下是______L.| 反应时间/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com