
题目列表(包括答案和解析)
可持续发展是全球经济发展的共同课题,珍惜地球,保护环境已成为我国的基本国策.汽车尾气(含烃类,CO,SO2,NO等物质)是城市空气的污染源.治理方法之一是在汽车排气管上装一个“催化转换器”(用铂、钯合金作催化剂),它的特点是使CO与NO反应,生成两种可参与大气生态循环的无毒气体,并促使烃类充分燃烧及SO2催化氧化.
(1)写出CO与NO在催化剂作用下的反应方程式:________
(2)“催化剂转换器”的缺点是在一定程度上提高了空气的酸度,其原因是________
(3)控制城市空气污染源的方法可行的有
[ ]
(4)汽车尾气经“催化转换器”处理后的大量气体使地球的温室效应增强,下列叙述中不正确的是
[ ]
A.如果没有地球的自然温室效应,大多数的生命都将不存在
B.全球工业发展造成温室效应的增加,导致全球变暖
C.限制发展中国家的工业气体排放,可以使大气中温室气体浓度趋于稳定水平
D.森林大幅度地吸收二氧化碳,可缓解全球温室效应的危机
(5)现代科学技术的迅速发展和广泛应用,带来了经济增长,却使全球面临资源枯竭、环境污染、生态污染和生态失衡等一系列危机,这说明
[ ]
A.任何事物都是一分为二的
B.科学技术的发展是产生危机的根源
C.旧的矛盾解决了,又会产生新的矛盾
D.规律是客观的,违背规律是要遭到惩罚的
| 1 |
| 2 |
| 1 |
| 2 |
 CH3OH(g) △H1=-116 kJ/mol
CH3OH(g) △H1=-116 kJ/mol △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1  △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1 
 CH3OH(g) 的平衡常数K =__________。
CH3OH(g) 的平衡常数K =__________。 CH3OH(g) △H1=-116 kJ/mol
CH3OH(g) △H1=-116 kJ/mol △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1  △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1 
 CH3OH(g) 的平衡常数K =__________。
CH3OH(g) 的平衡常数K =__________。欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
____C+____K2Cr2O7+ ____ → _____CO2↑+_____K2SO4 + ____ Cr2(SO4)3+____H2O
①完成并配平上述化学方程式。
②在上述方程式上标出该反应电子转移的方向与数目。
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+ 2H2(g) CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
①下列措施中有利于增大该反应的反应速率的是_________;
A.随时将CH3OH与反应混合物分离
B.降低反应温度
C.增大体系压强
D.使用高效催化剂
②已知:  △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1  △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1
则表示1mol气态甲醇燃烧生成CO2和水蒸气时的热化学方程式为 ___________ ;
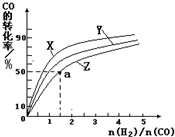
③在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。下图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。

 CH3OH(g)的平衡常数K =___________ 。
CH3OH(g)的平衡常数K =___________ 。湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com