
题目列表(包括答案和解析)
| 温度/ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
2- 3 |
- 3 |
2- 3 |
- 3 |
- 3 |
2- 3 |
2- 3 |
- 3 |
化学反应原理在工业生产中具有十分重要的意义。
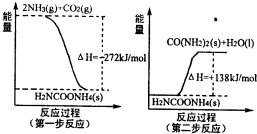
(1)工业生产可以用NH3(g)与CO2(g)经过两步反应生成尿素,两步反应的能量变化示意图如下:
则NH3(g)与CO2(g)反应生成尿素的热化学方程式为 。
(2)已知反应Fe(s) +CO2(g)  FeO(s) +CO(g) ΔH ="a" kJ/mol
FeO(s) +CO(g) ΔH ="a" kJ/mol
测得在不同温度下,该反应的平衡常数K随温度的变化如下:
①该反应的化学平衡常数表达式K= ,a 0(填“>”、“<”或“=”)。在500℃ 2L密闭容器中进行反应,Fe和CO2的起始量均为4 mol,则5 min后达到平衡时CO2的转化率为 ,生成CO的平均速率v(CO)为 。
②700℃反应达到平衡后,要使该平衡向右移动,其他条件不变时,可以采取的措施有
(填字母)。
| A.缩小反应器容积 | B.增加Fe的物质的量 |
| C.升高温度到900℃ | D.使用合适的催化剂 |
(10分) 化学平衡移动原理同样也适用于其它平衡, 已知在氨水中存在下列平衡:NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4+ +OH-。
NH4+ +OH-。
(1)向氨水中加入 MgCl2固体时,平衡向 (填“正反应或逆反应”下同)方向移动,OH- 离子浓度 ,NH4+的浓度 。
(2)向氨水中加入浓盐酸,平衡向 方向移动,此时溶液中浓度减小的微粒有 、 、 。
(3)向浓氨水中加入少量NaOH固体,平衡向 方向移动,此时观察到的现象是 ,原因是 。

| 10-7y |
| x-y |
| 10-7y |
| x-y |
 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡 CO2+H2。已知部分物质燃烧的热化学方程式如下:
CO2+H2。已知部分物质燃烧的热化学方程式如下:湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com