
题目列表(包括答案和解析)
Cr2O![]() +H2O
+H2O![]() 2HCrO
2HCrO![]() HCrO
HCrO![]()
![]() H++CrO
H++CrO![]()
已知Na2Cr2O7和Na2SO4的溶解度曲线如下图所示。为把含有少量Na2SO4的Na2Cr2O7晶体提纯,可采取以下方法:①趁热过滤;②用降温法结晶分离出Na2Cr2O7;③加适量水将含有少量杂质的Na2Cr2O7溶解成饱和溶液;④加热至100 ℃以上蒸发收缩;⑤加稀H2SO4酸化。
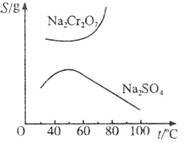
(1)操作步骤的正确顺序是(填序号)____________________________。
(2)用稀H2SO4酸化的目的是__________________________________________。
(3)趁热过滤的目的是__________________________________________。
Na2Cr2O7的水溶液中存在下列平衡: ,
, .已知Na2Cr2O7和Na2SO4的溶解度曲线如下图所示,可采用以下方法将Na2Cr2O7中混有的Na2SO4除去:①趁热过滤 ②用降温法析出晶体,分离出Na2Cr2O7 ③加适量水将含有少量杂质的Na2Cr2O7溶解成饱和溶液 ④加热至100℃以上蒸发浓缩 ⑤加稀H2SO4酸化。
.已知Na2Cr2O7和Na2SO4的溶解度曲线如下图所示,可采用以下方法将Na2Cr2O7中混有的Na2SO4除去:①趁热过滤 ②用降温法析出晶体,分离出Na2Cr2O7 ③加适量水将含有少量杂质的Na2Cr2O7溶解成饱和溶液 ④加热至100℃以上蒸发浓缩 ⑤加稀H2SO4酸化。
(1)实现上述目的的操作步骤的正确顺序是___(填序号)。
(2)用稀H2SO4酸化的目的是_______。
(3)趁热过滤的目的是____________。

工业上生产红矾(重铬酸钠Na2Cr2O7)的原料为铬铁矿(可视为FeO·Cr2O3、还含有Al2O3、SiO2).某研究性学习小组模拟工业生产红矾的原理制备红矾,并以红矾为原料制备少量的重铬酸钾(K2Cr2O7).实验流程为:

已知焙烧时Al2O3、SiO2发生反应:
SiO2+CaCO3![]() CaSiO3+CO2↑ Al2O3+Na2CO3
CaSiO3+CO2↑ Al2O3+Na2CO3![]() 2NaAlO2+CO2↑
2NaAlO2+CO2↑
焙烧时铬铁矿发生反应:
4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
(1)步骤①应将反应物装在________(填仪器名称)中焙烧;步骤④需要用到的玻璃仪器________________.
(2)步骤③用硫酸将溶液的pH调至7~8,目的是________________;并写出有关的离子方程式________________.
(3)滤液加入硫酸酸化过程中,溶液由黄色变为橙色,反应的离子方程式为________________.
(4)将红矾钠与KCl固体1∶2(物质的量比)混合溶于水后经适当操作可得到K2Cr2O7晶体.②③④的实验操作方法分别是________________.


| rO | 2- 4 |
| r2O | 2- 7 |
| 温度 化学式 |
20℃ | 60℃ | 100℃ |
| Na2SO4 | 19.5 | 45.3 | 42.5 |
| Na2Cr2O7 | 183 | 269 | 415 |
| Na2CrO4 | 84 | 115 | 126 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com