
题目列表(包括答案和解析)

| ||
| ||
| ||
| ||
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:
⑴O、Si、N元素的电负性由大到小的顺序是____________________。C60和金刚石都是碳的同素异形体,二者中熔点较高的是____________。
⑵A为短周期金属元素,依据下表数据,A的基态原子的轨道表示式为
________________________________。
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |



研究物质的微观结构,有助于人们理解物质变化的本质。请回答:
(1)C、Si、N元素的电负性由大到小的顺序是 ,C60和金刚石都是碳的同素异形体,金刚石熔点高于C60的熔点,原因是 ;
(2) A、B均为短周期金属元素。依据下表数据,写出B原子的电子排布式 ;
|
电离能/kJ•mol-1 |
I1 |
I2 |
I3 |
I4 |
|
A |
932 |
1821 |
15390 |
21771 |
|
B |
738 |
1451 |
7733 |
10540 |
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色。据此判断,[Mn(H2O)6]2+ 颜色(填“无”或“有”);
(4)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等。
① COCl2分子的结构式为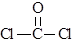 ,COCl2分子内含有
(填标号);
,COCl2分子内含有
(填标号);
A.4个σ键 B.2个σ键、2个π键 C.2个σ键、1个π键 D.3 个σ键、1个π键
② Fe(CO)5在一定条件下发生分解反应:Fe(CO)5=Fe(s)+5CO,反应过程中,断裂的化学键只有配位键,形成的化学键是 。
研究物质的微观结构,有助于人们理解物质变化的本质。请回答:
(1)C、Si、N元素的电负性由大到小的顺序是 ,C60和金刚石都是碳的同素异形体,金刚石熔点高于C60的熔点,原因是 ;
(2) A、B均为短周期金属元素。依据下表数据,写出B原子的电子排布式 ;
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色。据此判断,[Mn(H2O)6]2+ 颜色(填“无”或“有”);
(4)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等。
① COCl2分子的结构式为![]() ,COCl2分子内含有 (填标号);
,COCl2分子内含有 (填标号);
A.4个σ键 B.2个σ键、2个π键 C.2个σ键、1个π键 D.3 个σ键、1个π键
② Fe(CO)5在一定条件下发生分解反应:Fe(CO)5=Fe(s)+5CO,反应过程中,断裂的化学键只有配位键,形成的化学键是 。
(11分)A、B、C、D是四种短周期元素,它们的原子序数依次增大。其中A、D元素同主族,B、C元素同周期;由A、B、C、D中的两种元素可形成原子个数比为1:1的多种化合物,甲、乙、丙、丁为其中的四种,它们的元素组成如下表所示: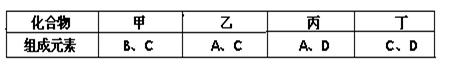
常温下,甲物质为气体,密度略小于空气;乙物质为液体;丙物质和丁物质为固体且都为离子化合物。请填写下列空白:
(1)丙物质的电子式为 ,丁物质中阴离子与阳离子的个数之比为 。
(2)若标准状况下5.6L甲物质完全燃烧放出的热量为QKJ,试写出表示甲物质燃烧热的热化学方程式 。
(3)B、C两种元素按原子个数比为1:2可形成化合物戊,A、C、D三种元素按原子个数比为1:1:1可形成化合物己,则己与戊按物质的量之比为3:2完全反应后的溶液中各离子浓度的大小关系为 。
(4)某同学设计了一个以结构简式是BA3-CA物质为燃料的电池,并用该电池电解200mL一定浓度NaCl与CuSO4混合溶液,其装置如下图: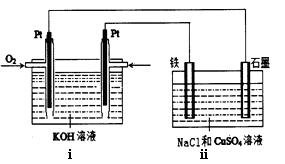
①写出ⅰ中通入该物质这一极的电极反应式 。
②理论上ⅱ中两极所得气体的体积随时间变化的关系如坐标图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式 ;在t2时所得溶液的pH约为 。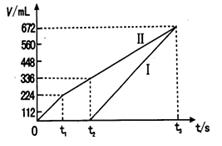
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com