
题目列表(包括答案和解析)


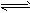 2NH3(l) △H =________,该热化学反应方程式的意义是_______________。
2NH3(l) △H =________,该热化学反应方程式的意义是_______________。 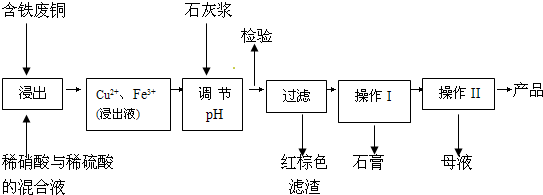
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
0.5mol氢气和0.5mol碘晶体完全反应,生成1mol碘化氢气体,吸收26.5 kJ 的热,则下列热化学方程式正确的是 ( )
A.H2(g) + I2(s)  2HI(g) - 26.5kJ 2HI(g) - 26.5kJ |
B.H2 + I2 2HI - 53kJ 2HI - 53kJ |
C.H2(g) + I2(s)  2HI(g) - 53kJ 2HI(g) - 53kJ |
D.0.5H2 + 0.5I2  HI - 26.5kJ HI - 26.5kJ |
(11分)硫酸铜是一种应用极其广泛的化工原料;以下是某工厂用含铁废铜为原料生产胆矾(CuSO4·5H2 O)和副产物 石膏(CaSO4·2H2O)的生产流程示意图:
石膏(CaSO4·2H2O)的生产流程示意图: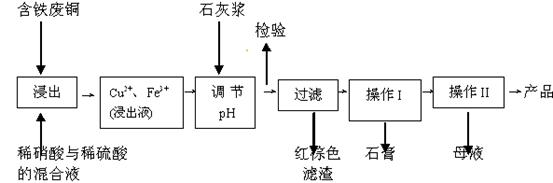
胆矾和石膏在不同温度下的溶解度(g/100g水)见下表。
温度(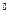 C) C) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32[来源:Z|xx|k.Com] | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8[来源:学*科*网] | 114 |
 C左右;
C左右;0.5mol氢气和0.5mol碘晶体完全反应,生成1mol碘化氢气体,吸收26.5 kJ 的热,则下列热化学方程式正确的是
A.H2(g)
+ I2(s) 2HI(g) - 26.5kJ
2HI(g) - 26.5kJ
B.H2
+ I2 2HI - 53kJ
2HI - 53kJ
C.H2(g)
+ I2(s) 2HI(g) - 53kJ
2HI(g) - 53kJ
D.0.5H2
+ 0.5I2 HI - 26.5kJ
HI - 26.5kJ
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com